Genética y biología celular del cáncer: neoplasias linfoblásticas T
Resumen de Investigación:
Las neoplasias linfoblásticas T son enfermedades hematológicas que necesitan de manera urgente la identificación de nuevos biomarcadores que permitan su estratificación y el ajuste de las dosis de los fármacos utilizados. Por tanto, el objetico central de nuestro trabajo es la identificación de nuevos biomarcadores moleculares para proponer tratamientos más efectivos y menos tóxicos. A tal efecto nuestro planteamiento ha sido abordar el análisis de modelos animales y de muestras de tumores primarios mediante aproximaciones genómicas y transcriptómicas como punto de partida para la identificación de nuevos “drivers” y mecanismos implicados. En los últimos años hemos demostrado la implicación de la sobre-expresión de oncogenes críticos (tales como c-MYC, ABL1, BCR-ABL y SMO) debido al efecto combinatorio de la inactivación de múltiples microRNAs, y la inactivación de genes supresores mediante el efecto simultáneo de deleciones y alteraciones epigenéticas (CDKN2A, CDKN2B and EPHA7). Nuestros datos evidenciaron un considerable grado de heterogeneidad intratumoral alimentada por procesos de editado de RNA. Entre nuestras contribuciones más recientes hemos demostrado que la desregulación del eje CDKN1C-E2F1-TP53 mediante mecanismos epigenéticos y la desregulación de microRNAs puede ser un predictor de agresividad tumoral. Aprovechando los datos derivados de la secuenciación de exomas y la versatilidad del RNA-seq hemos identificado nuevas mutaciones y cambios de expresión génica que sirven para la propuesta de nuevas terapias dirigidas en el contexto de una medicina personalizada de precisión. Nuestros resultados también han servido para identificar nuevos transcritos de fusión que podrían comportarse como nuevos “drivers” o contribuyentes en el proceso tumoral. También hemos demostrado que la inactivación de diferentes isoformas del gen supresor FBXW7 es una condición sine qua non para inducir un patrón proliferativo en las células tumorales. Además hemos demostrado que la fosforilación de FADD puede servir como predictor de estatus clínico y agresividad. Finalmente hemos demostrado que la inhibición de la actividad aconitasa con fluorocitrato disminuye la viabilidad de las células tumorales que presentan un déficit parcial de actividad ACO1. Este hallazgo fue confirmado mediante experimentos in vivo con xenotrasplantes inducidos en ratón mediante la inoculación de células tumorales derivadas de neoplasias linfoblásticas T. Nuestro interés más reciente se centra en evaluar la implicación de los procesos de editado de RNA, el tráfico de exosomas y la desregulación de genes no codificantes (largos y cortos) para conseguir una visión integral completa de las complicadas redes de mecanismos de regulación alterados en este tipo de neoplasias hematológicas. Nuestra pertenencia al CIBER de enfermedades raras y al Instituto de Investigación Sanitario Fundación Jiménez Díaz está facilitando nuestra capacidad traslacional.
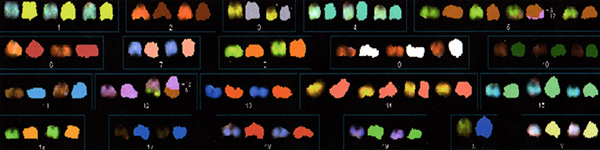
Figura 1. Cariotipo espectral anormal en una muestra de linfoma linfoblástico T murino.
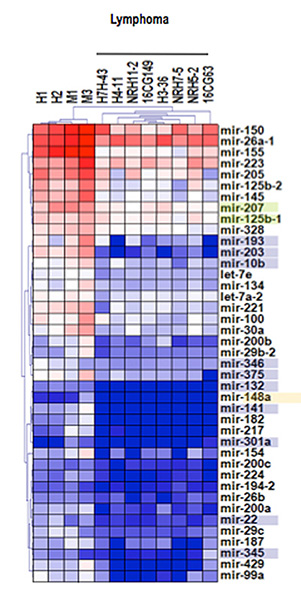
Figura 2. Perfiles transcripcionales de miRNAs en linfomas linfoblásticos T murinos.
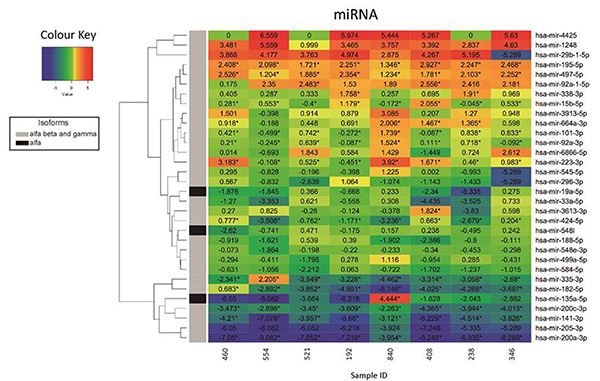
Figura 3. Representación gráfica (Heatmap) de los cambios en la expression de microRNAs especificos mediante RNA-seq.
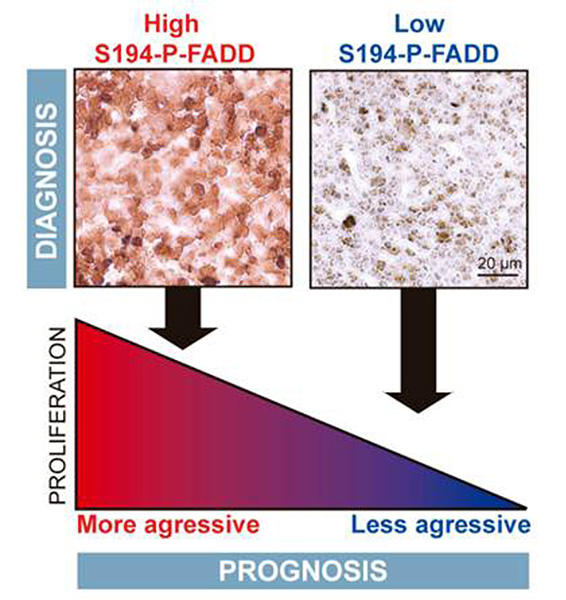
Figura 4. Modelo de asociación entre la fosforilación de FADD y el pronóstico de linfomas linfoblásticos T.
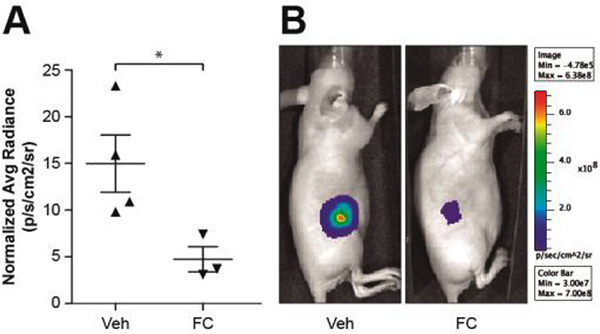
Figura 5. Efecto del fluorocitrato sobre tumores inducidos en ratones mediante xenotransplante de células tumorales derivadas de una neoplasia linfoblástica T.

| Apellidos | Nombre | Laboratorio | Ext.* | Categoría profesional | |
|---|---|---|---|---|---|
| Blázquez Castro | Alfonso | 327 | 4653 | Tco. de Investigación y Laboratorio | |
| Cobos Fernández | Mª Angeles | 327 | 4653 | macobos(at)cbm.csic.es | Titulado Superior Grado de Doctor |
| González Vasconcellos | Iria | 327 | 4653 | iria.gonzalez(at)cbm.csic.es | Titulado Sup.de Actividades Técn. y Profes. GP1 |
| Lahera Alonso | Antonio | 327 | 4653 | a.lahera(at)cbm.csic.es | Tit.Sup.Activ.Técn.y Profes. GP1 |
| López Nieva | María del Pilar | 327 | 4653 | pilar.lopez(at)cbm.csic.es | Contratado CIBER |
| Ruiz García | Sara | 327 | 4653 | s.garcia@cbm.csic.es | Tit.Sup.Activ.Técn.y Profes. GP1 |
| Santos Hernández | Javier | 327 | 4627/4653 | jsantos(at)cbm.csic.es | Catedrático Universidad, GA |
| Vela Martín | Laura | 327 | 4653 | Tco. de Investigación y Laboratorio | |
| Vaquero Lorenzo | Concepción | 327 | 4653 | cvaquero(at)cbm.csic.es | Titulado Sup.de Actividades Técn. y Profes. GP1 |
| Villa Morales | María Consuelo | 327 | 4653 | mvilla(at)cbm.csic.es | Profesor Contratado Universidad, GA |
Publicaciones relevantes:
- Pilar López-Nieva, Pablo Fernández-Navarro, Osvaldo Graña-Castro, Eduardo Andrés-León, Javier Santos, María Villa-Morales, María Ángeles Cobos-Fernández, Laura González-Sánchez, Marcos Malumbres, María Salazar-Roa, and José Fernández-Piqueras. Detection of novel fusion-transcripts by RNA-Seq in T-cell lymphoblastic lymphoma. Scientific Reports (2019) 9 (1) : 5179 doi: 10.1038/s41598-019-41675-3.
- Laura Gonzalez-Sanchez, Maria Á. Cobos-Fernandez, Pilar Lopez-Nieva, Maria Villa-Morales, K Stamatakis, Jose M. Cuezva, Jose L. Marin Rubio, Irene Vazquez-Dominguez, Iria Gonzalez-Vasconcellos, Eduardo Salido, Pilar Llamas, Jose L. Lopez-Lorenzo, J Santos and Jose Fernandez-Piqueras*. TITULO: Exploiting the passenger ACO1-deficiency arising from 9p21 deletions to kill T-cell lymphoblastic neoplasia cells. Carcinogenesis. 2019 Nov 17. pii: bgz185. doi: 10.1093/carcin/bgz185.
- Vázquez-Domínguez, I., González-Sánchez, L., López-Nieva, P., Villa-Morales, M., Cobos- Fernández, M.A., Sastre, I., Fraga, M.F., Fernández, A. F., Malumbres, M., Salazar-Roa, M., Graña-Castro, O., Santos, J., Llamas, P., López-Lorenzo, J.L. and Fernández-Piqueras, J. Downregulation of specific FBXW7 isoforms with differential effects in T-cell lymphoblastic lymphoma. Oncogene (2018) doi: 10.1038/s41388-019-0746-1.
- Marín-Rubio, J.L,. Pérez-Gómez, E., Fernández-Piqueras, J. and Villa-Morales, M. S194-P-FADD as a marker of aggressiveness and poor prognosis in human T-cell lymphoblastic lymphoma. Carcinogenesis (2018) pii: bgz041. doi: 10.1093/carcin/bgz041
- Roncero AM, López-Nieva P, Cobos-Fernández MA, Villa-Morales M, González-Sánchez L, López-Lorenzo JL, Llamas P, Ayuso C, Rodríguez-Pinilla SM, Arriba MC, Piris MA, Fernández-Navarro P, Fernández AF, Fraga MF, Santos J, Fernández-Piqueras J. Contribution of JAK2 to T-cell lymphoblastic lymphoma. REVISTA: Leukemia (2016) Jan;30(1):94-103. doi: 10.1038/leu.2015.202.
- Eduardo Pérez-Gómez, Clara Andradas, María M. Caffarel, Sandra Blasco-Benito, Elena García-Taboada, María Villa-Morales, Estefanía Moreno, Sigrid Hamann, Juana M. Flores, Ester Martín, Antonia Wenners, Ibrahim Alkatout, Wolfram Klapper, Maret Bauer, Norbert Arnold, Joaquín Soriano, Manuel Pérez, Diego Megías, Gema Moreno-Bueno, Silvia Ortega-Gutiérrez, Marta Artola, Henar Vázquez-Villa, Miguel Quintanilla, José Fernández-Piqueras, Enric I. Canela, Peter J. McCormick, Manuel Guzmán and Cristina Sánchez. Cannabinoid receptor CB2 is a pivotal regulator of HER2 oncogenic signaling in breast cáncer. REVISTA J Natl Cancer Inst. 2015 Apr 8;107(6). pii: djv077. doi: 10.1093/jnci/djv077.
- Bueno MJ, Gómez de Cedrón M, Pérez de Castro I, Gómez-López G, Di Lisio L, Montes Moreno S, Martínez N, Guerrero M, Sánchez-Martínez R, Santos J, Pisano, DG, Piris MA, Fernández-Piqueras J and Malumbres M (2011) Combinatorial effects of microRNAs to suppress the Myc oncogenic pathway. Blood 117(23): 6255-66.
- Bueno MJ, Gómez de Cedrón M, Laresgoiti U, Fernández-Piqueras J, Zubiaga A and Malumbres M (2010) Multiple E2F-induced microRNAs prevent replicative stress in response to mitogenic signalling. Molecular Cellular Biology 30 (12): 2983-2995.
- Santos J, González-Sánchez L, Matabuena-de Yzaguirre M, Villa-Morales M, Cozar P, López-Nieva P, Fernández-Navarro P, Fresno M, Díaz MD, Guenet JL, Montagutelli X & Fernández-Piqueras J. (2009) A role for stroma-derived Annexin A1 as mediator in the control of genetic susceptibility to T-cell lymphoblastic malignancies through PGE2 secretion. Cancer Res 69(6): 2577-87.
- Bueno MJ, Pérez de Castro I, Gómez de Cedrón M, Santos J, Calin GA, Cigudosa JC, Croce CM, Fernandez-Piqueras J, Malumbres M (2008) Genetic and epigenetic silencing of microRNA-203 enhances ABL1 and BCR-ABL1 oncogene expression. Cancer Cell, 13: 496-506.




















