Mantenimiento y variabilidad del genoma: enzimología de la replicación y reparación de DNA
Resumen de Investigación:
El proceso de replicación del DNA supone una fuente muy importante de inestabilidad genómica, debido a los reordenamientos que pueden ocurrir en sitios donde se atasque la horquilla de replicación. Estos problemas son denominados colectivamente “estrés replicativo” (RS; del inglés replicative stress). En los últimos 7 años, nuestro laboratorio ha contribuído a demostrar que la mayoría de lesiones en el DNA o estructuras aberrantes en la cadena molde que producen RS, pueden ser toleradas mediante nuevos iniciadores de replicación (primers de DNA) que son generados por PrimPol en la cadena adelantada (leading strand), inmediatamente tras la lesión.
Otro aspecto importante es que nuestro descubrimiento de PrimPol supone reconsiderar el escenario molecular en el que han de tener lugar las reacciones de tolerancia y reparación posteriores, pues implica que la lesión quedaría atras, sin bloquear el avance de la horquilla, confinada en un gap tras la acción de PrimPol, y que ese gap ha de ser reparado, rellenado y sellado. Actualmente estamos interesados en la identificación de proteinas interactoras de PrimPol, y del mecanismo de resolución de los gaps que sucede a la acción de PrimPol durante RS.
Tanto los ratones deficientes en PrimPol, como las células humanas deprivadas de PrimPol, son viables, pero muestran síntomas de inestabilidad genómica elevada. Es relevante mencionar que la eliminación de PrimPol durante la replicación del DNA nuclear y mitocondrial conlleva defectos en el avance de las horquillas de replicación, que son mas graves en presencia de diferentes agentes genotóxicos que generan RS. Como ejemplo, la deficiencia en PrimPol genera un fuerte y persistente incremento de la señalización del RS cuando las células son tratadas con inhibidores de replicación como la camptotecina y el etopósido, lo que es característico de las células cancerosas. Por tanto, nuestros datos apoyan que PrimPol podría ser una nueva y relevante diana en terapia antitumoral. Su deficiencia, ya sea por la presencia de mutaciones inactivantes específicas o por el uso de inhibidores específicos, en combinación con otros agentes genotóxicos conocidos, causaría un RS exacerbado que mataría a las células tumorales por “catástrofe replicativa”. Por ello, otro objetivo de nuestra investigación es la caracterización de variantes tumorales de la PrimPol humana con alterada actividad específica y defectos de su actividad primasa que pudieran tener un valor pronóstico en cáncer.
Desde una perspectiva biotecnológica, hemos puesto a punto un screening de alto rendimiento para obtener variantes de PrimPol con especificidad de reconocimiento debilitada que puedan ser útiles para mejorar un nuevo método de amplificación de DNA, denominado TruePrime™, que ha sido comercializado por Expedeon AG (actualmente 4BaseBio AG), para el diagnóstico de cáncer en biopsias líquidas.
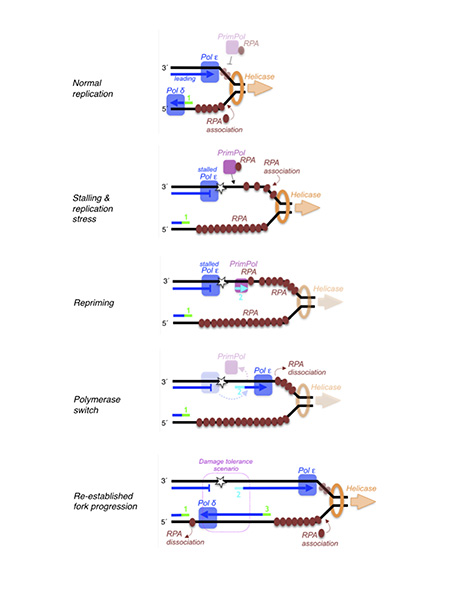
Figura 1. Representación esquemática de PrimPol actuando en una horquilla de replicación bloqueada. Una vez que PrimPol es reclutada por interacción con RPA y ha sintetizado un primer de DNA, se re-establece el avance de la horquilla de replicación, dejando atrás un gap que contiene una lesión o alteración estructural del DNA. Este gap será resuelto por DNA polimerasas de translesión (TLS), o utilizando como molde alternativo la “lagging strand” recien sintetizada.
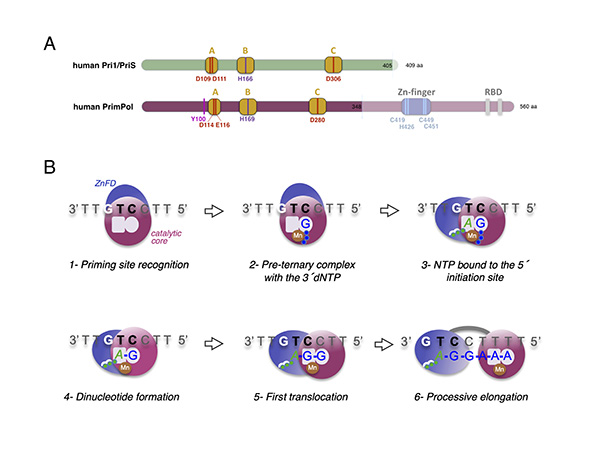
Figura 2. Mecanismo de DNA priming de la PrimPol humana. A) Comparación estructural de la primasa humana Pri1/PriS/p49 y PrimPol humana. B) Pasos secuenciales durante la síntesis de primers por PrimPol humana.

| Apellidos | Nombre | Laboratorio | Ext.* | Categoría profesional | |
|---|---|---|---|---|---|
| Blanco Dávila | Luis | 403 | 4685 | lblanco(at)cbm.csic.es | E. Profesores de Investigación de Organismos Públicos de Investigación |
| Guerra González | Susana | 403 | 4686 | sguerra(at)cbm.csic.es | Tco.Sup.Activ.Técn.y Profes. GP3 |
| Jiménez Juliana | Marcos | 403 | 4686 | marcos.j(at)cbm.csic.es | Titulado Sup. Actividades Tecn. y Prof.GP1 |
| Jiménez Mejías | Alejandra | 403 | 4686 | Estudiante TFM | |
| Martínez Jiménez | María Isabel | 403 | 4686 | maria_m(at)cbm.csic.es | Doctor FC3 |
| Olmos Guevara | Regina | 403 | 4686 | Estudiante |
Publicaciones relevantes:
- Blanco L, Calvo PA, Diaz-Talavera A, Carvalho G, Calero N, Martínez-Carrón A, Velázquez-Ruiz C, Villadangos S, Guerra S, Martínez-Jiménez MI (2019) Mechanismn of DNA primer synthesis by human PrimPol. Enzymes 45, 289-310. Review.
- Calvo PA, Sastre-Moreno G, Perpiñá C, Guerra S, Martínez-Jiménez MI, Blanco L (2019) The invariant glutamate of human PrimPol DxE motif is critical for its Mn2+-dependent distinctive activities. DNA Repair (Amst) 77, 65-75.
- Díaz-Talavera A, Calvo PA, González-Acosta D, Díaz M, Sastre-Moreno G, Blanco-Franco L, Guerra S, Martínez-Jiménez MI, Méndez J, Blanco L (2019) A cancer-associated point mutation disables the steric gate of human PrimPol. Rep. Feb 4;9(1):1121.
- Martínez-Jiménez MI, Calvo PA, García-Gómez S, Guerra-González S, Blanco L (2018) The Zn-finger of human PrimPol is required to stabilize the initiating nucleotide during DNA priming. Nucleic Acids Res. 46, 4138-4151.
- Torregrosa-Muñumer R, Forslund JME, Goffart S, Pfeiffer A, Stojkovič G, Carvalho G, Al-Furoukh N, Blanco L, Wanrooij S, Pohjoismäki JLO. (2017) PrimPol is required for replication reinitiation after mtDNA damage. Proc Natl Acad Sci U S A. 114, 11398-11403.
- Agudo R, Calvo PA, Martínez-Jiménez MI, Blanco L (2017) Engineering human PrimPol into an efficient RNA-dependent-DNA primase/polymerase. Nucleic Acids Res. 45, 9046-9058.
- Martínez-Jiménez MI, Lahera A, Blanco L (2017) Human PrimPol activity is enhanced by RPA. Sci Reports. 7(1):783. doi: 10.1038/s41598-017-00958-3. PMID: 28396594.
- Picher AJ, Wafzig O, Krüger C, García-Gómez S, Martínez-Jiménez MI, Díaz-Talavera A, Blanco L* and Armin Schneider S* (2016) TruePrime, a novel method for whole genome amplification from single cells based on TthPrimPol. *co-corresponding authors. Nature Commun. 7:13296 | doi: 10.1038/ncomms13296.
- Mouron S, Rodriguez-Acebes S, Martinez-Jimenez MI, Garcia-Gomez S, Chocrón ES, Blanco L*, Mendez J* (2013). Repriming of DNA synthesis at stalled replication forks by human PrimPol. *co-corresponding authors. Nature Structural & Molecular Biology 20, 1383-1389.
- Garcia-Gomez S, Reyes A, Martinez-Jimenez MI, Chocrón ES, Mouron S, Terrados G, Powell C, Salido, E, Mendez J, Holt IJ, Blanco L (2013). PrimPol, an Archaic Primase/Polymerase Operating in Human Cells. Molecular Cell 52, 541-53.
Tesis doctorales:
- Sara García Gómez (2013). “PrimPol, una nueva primasa/polimerasa en células humanas”. Universidad Autónoma de Madrid. Directores: Luis Blanco Dávila y María I. Martínez Jiménez.
- Ana Gómez Bedoya (2013). “Análisis estructura-función de la DNA polimerasa lambda humana y su implicación en la reparación del DNA mediante NHEJ”. Universidad Autónoma de Madrid. Director: Luis Blanco Dávila.
- Ana Aza Montoya (2014). “In vivo role of DNA polymerases lambda and mu in Genome Stability”. Universidad Autónoma de Madrid. Directores: Luis Blanco Dávila y Gloria Terrados Aguado.
- Guillermo Sastre Moreno (2016). “Polymerases specialized in damage tolerance and DNA double-strand break repair”. Universidad Autónoma de Madrid Directores: Luis Blanco Dávila y José F. Ruiz Pérez.
- Patricia A. Calvo Fernández (2019). “Structure-function analysis of human PrimPol”. Universidad Autónoma de Madrid. Directores: Luis Blanco Dávila y María I. Martínez Jiménez.
Patentes:
- A. Picher y L. Blanco. Title: Methods for amplification and sequencing using thermostable TthPrimPol. Priority number: EP13159629. Country of priority: Europe Priority date: 15 March 2013. Owner: Expedeon AG.
Otras actividades:
- Coordinador del módulo (BM6): "Estabilidad de la Información Genética: Replicación, Reparación y Mutagénesis", correspondiente al Master de Biología Molecular y Celular, impartido por la Universidad Autónoma de Madrid (UAM).
- XX Premio Carmen y Severo Ochoa en Biología Molecular (2014).




















