Respuesta celular al estrés y morfogénesis
Resumen de Investigación:
Durante el desarrollo, las células deben coordinar su capacidad de proliferar con la de ser eliminadas cuando son defectuosas. Este proceso es fundamental para mantener la homeostasis del tejido y generar órganos funcionales. Esto es particularmente importante después de un daño tisular, ya que los órganos deben compensar la pérdida de células durante el proceso de regeneración. Defectos en la coordinación entre la proliferación celular y la muerte celular o apoptosis podrían dar lugar al desarrollo de tumores y malformaciones en los órganos.
Nuestro principal objetivo es comprender cómo responden las células a diferentes tipos de estrés para mantener la homeostasis de los tejidos. Además, estamos interesados en los mecanismos moleculares y celulares que controlan la especificación celular y la morfogénesis durante el desarrollo. Para ello, utilizamos la mosca de la fruta o Drosophila como organismo modelo. Drosophila se ha establecido como uno de los organismos más poderosos para modelar procesos biológicos y enfermedades humanas, en parte esto es gracias a su considerable similitud genética con los mamíferos y la abundancia de herramientas genéticas disponibles. Es importante destacar que el 90% de los genes identificados por The Cancer Genome Atlas como implicados en el desarrollo del cáncer humano tienen un ortólogo en la mosca.
Nuestros objetivos principales son:
1-¿Cómo se forman los apéndices? Estudiamos cómo se especifican las extremidades de la mosca (patas y alas) en el embrión y cómo se subdividen posteriormente en territorios con diferentes identidades celulares. También investigamos como esta información se traduce en comportamientos celulares para generar la forma final de una extremidad en tres dimensiones. A nivel molecular, un pequeño número de vías de señalización y factores de transcripción se utilizan de manera reiterada a lo largo del desarrollo para especificar y modelar los apéndices tanto en Drosophila como en vertebrados.
2-Coordinación entre proliferación celular y apoptosis durante la homeostasis tisular. Los mecanismos que controlan la proliferación celular y la apoptosis en respuesta a diferentes tipos de estrés deben estar estrechamente coordinados y equilibrados para mantener la integridad genómica y prevenir el desarrollo de tumores. Las células defectuosas deben eliminarse rápidamente para evitar la transmisión de mutaciones y la formación de células malignas. Cuáles son los mecanismos moleculares que regulan la división celular y la muerte celular es una cuestión importante con enormes implicaciones en el campo de la biología del cáncer.
3-Mecanismos de regeneración en el sistema epitelial y nervioso. La regeneración es la capacidad que presentan algunos organismos para reparar órganos o tejidos dañados. Esta capacidad difiere, no sólo entre diferentes especies, sino también entre diferentes etapas de desarrollo de un mismo organismo. Uno de nuestros objetivos es identificar las señales celulares que promueven y limitan la capacidad regenerativa de un organismo durante el desarrollo.
Cuando se daña el tejido neural se induce una respuesta regenerativa que tiene como objetivo preservar la integridad estructural y la función del sistema nervioso. Esta respuesta regenerativa está mediada principalmente por células gliales. Investigamos los mecanismos genéticos y moleculares que controlan la respuesta glial tras un daño.
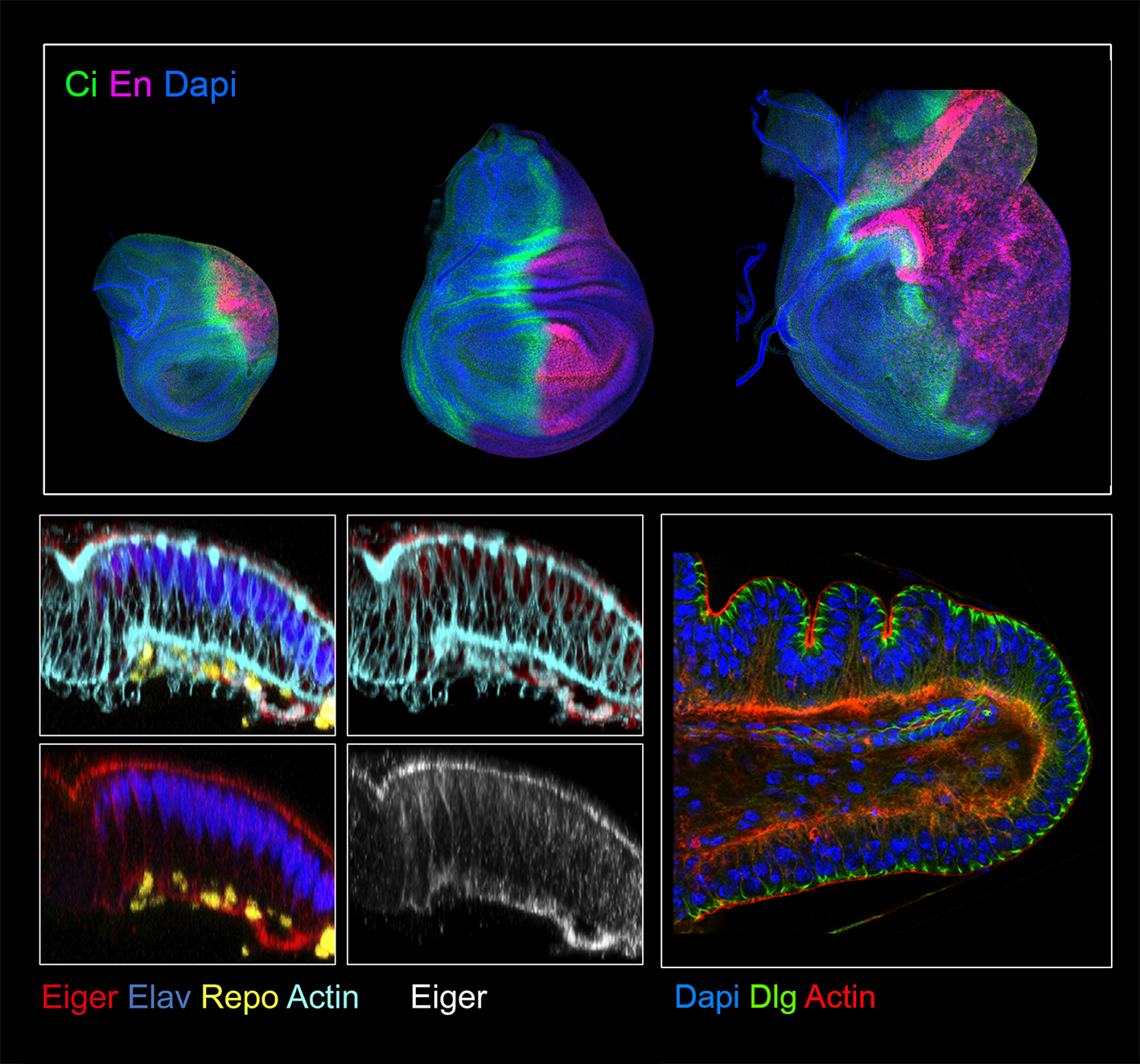
Figura 1. Resumen de los distintos proyectos que llevamos en el laboratorio. Discos imaginales teñidos con diferentes proteínas implicadas en regeneración, homeostasis de tejidos y morfogénesis.

| Last name | Name | Laboratory | Ext.* | Professional category | |
|---|---|---|---|---|---|
| Baonza Cuenca | Antonio | 425 | 4436 | abaonza(at)cbm.csic.es | E.Científicos Titulares de Organismos Públicos de Investigación |
| Estella Sagrado | Carlos | 415.3 | 4402 | cestella(at)cbm.csic.es | E.Científicos Titulares de Organismos Públicos de Investigación |
| Castellanos Aguilar | César | 421 | 4436 | cesar.castellanos(at)cbm.csic.es | M3 Predoc.formación |
| Kelleher López | Inés | 421 | 4436 | ikelleher(at)cbm.csic.es | Becario JAE Intro |
| Pérez Aguilera | Marina | 421 | 4436 | mperez(at)cbm.csic.es | M2 |
| Tur Gracia | Sara | 421/405 | 4702 | sara.tur(at)cbm.csic.es | Titulado Sup. Actividades Tecn. y Prof.GP1 |
Publicaciones relevantes:
-
Garcia-Arias JM, Pinal N, Cristobal-Vargas S, Estella C, Morata G. Lack of apoptosis leads to cellular senescence and tumorigenesis in Drosophila epithelial cells. Cell Death Discov. 2023 Aug 2;9(1):281. doi: 10.1038/s41420-023-01583-y. PMID: 37532716; PMCID: PMC10397273.
-
Velarde SB, Baonza A. Glial regenerative response in the imaginal discs of Drosophila melanogaster. Neural Regen Res. 2023 Jan;18(1):109-110. doi: 10.4103/1673-5374.339479.PMID: 35799518
-
Baonza A, Tur-Gracia S, Pérez-Aguilera M, Estella C. Regulation and coordination of the different DNA damage responses in Drosophila. Front Cell Dev Biol. 2022 Sep 6;10:993257. doi: 10.3389/fcell.2022.993257. PMID: 36147740; PMCID: PMC9486394.
-
Ruiz-Losada M, González R, Peropadre A, Gil-Gálvez A, Tena JJ, Baonza A, Estella C. Coordination between cell proliferation and apoptosis after DNA damage in Drosophila. Cell Death and Differentiation, 10.1038/s41418-021-00898-6. 25 Nov. 2021, doi:10.1038/s41418-021-00898-6. PMID: 34824391
-
Ruiz-Losada M, Pérez-Reyes C, Estella C. Role of the Forkhead Transcription Factors Fd4 and Fd5 During Drosophila Leg Development. Front Cell Dev Biol. 2021 Aug 2;9:723927. doi: 10.3389/fcell.2021.723927. PMID: 34409041; PMCID: PMC8365472.
-
Velarde SB, Quevedo A, Estella C, Baonza A. Dpp and Hedgehog promote the glial response to neuronal apoptosis in the developing Drosophila visual system. PLoS Biol. 2021 Aug 11;19(8):e3001367. doi: 10.1371/journal.pbio.3001367. PMID: 34379617; PMCID: PMC8396793.
-
Blom-Dahl D, Córdoba S, Gabilondo H, Carr-Baena P, Díaz-Benjumea FJ, Estella C. In vivo analysis of the evolutionary conserved BTD-box domain of Sp1 and Btdduring Drosophila development. Dev Biol. 2020 Oct 1;466(1-2):77-89. doi:10.1016/j.ydbio.2020.07.011. Epub 2020 Jul 29. PMID: 32738261.
-
Córdoba S, Estella C. Role of Notch Signaling in Leg Development in Drosophila melanogaster. Adv Exp Med Biol. 2020;1218:103-127. doi:10.1007/978-3-030-34436-8_7. PMID: 32060874.
-
Córdoba S, Estella C. The transcription factor Dysfusion promotes fold and joint morphogenesis through regulation of Rho1. PLoS Genet. 2018 Aug 6;14(8):e1007584. doi: 10.1371/journal.pgen.1007584. PMID: 30080872; PMCID:PMC6095628.
-
Ruiz-Losada M, Blom-Dahl D, Córdoba S, Estella C. Specification and Patterning of Drosophila Appendages. J Dev Biol. 2018 Jul 14;6(3):17. doi: 10.3390/jdb6030017. PMID: 30011921; PMCID: PMC6162442.
-
Cheng L, Baonza A, Grifoni. Drosophila Models of Human Disease. D. Biomed Res Int. 2018 Aug 30;2018:7214974. doi: 10.1155/2018/7214974. eCollection 2018.PMID: 30228988
-
Ahmed-de-Prado S, Diaz-Garcia S, Baonza A. JNK and JAK/STAT signalling are required for inducing loss of cell fate specification during imaginal wing discs regeneration in Drosophila melanogaster. Dev Biol. 2018 Sep 1;441(1):31-41. doi: 10.1016/j.ydbio.2018.05.021. Epub 2018 Jun 2. PMID: 29870691
-
Ahmed-de-Prado S, Baonza A Drosophila as a Model System to Study Cell Signaling in Organ Regeneration. Biomed Res Int. 2018 Mar 19;2018:7359267. doi: 10.1155/2018/7359267. eCollection 2018.PMID: 29750169
-
Requena D, Álvarez JA, Gabilondo H, Loker R, Mann RS, Estella C. Origins andSpecification of the Drosophila Wing. Curr Biol. 2017 Dec 18;27(24):3826-3836.e5. doi: 10.1016/j.cub.2017.11.023. Epub 2017 Dec 7. PMID:29225023; PMCID: PMC5757315.
-
Córdoba S, Requena D, Jory A, Saiz A, Estella C. The evolutionarily conservedtranscription factor Sp1 controls appendage growth through Notch signaling. Development. 2016 Oct 1;143(19):3623-3631. doi: 10.1242/dev.138735. Epub 2016Aug 30. PMID: 27578786.
-
Diaz-Garcia S, Ahmed S, Baonza A. Analysis of the Function of Apoptosis during Imaginal Wing Disc Regeneration in Drosophila melanogaster. PLoS One. 2016 Nov 28;11(11):e0165554. doi: 10.1371/journal.pone.0165554. eCollection 2016.PMID: 27893747
-
Córdoba S, Estella C. The bHLH-PAS transcription factor dysfusion regulatestarsal joint formation in response to Notch activity during drosophila leg development. PLoS Genet. 2014 Oct 16;10(10):e1004621. doi: 10.1371/journal.pgen.1004621. PMID: 25329825; PMCID: PMC4199481.
-
Andrade-Zapata I, Baonza A. The bHLH factors extramacrochaetae and daughterless control cell cycle in Drosophila imaginal discs through the transcriptional regulation of the Cdc25 phosphatase string. PLoS Genet. 2014 Mar 20;10(3):e1004233. doi: 10.1371/journal.pgen.1004233. eCollection 2014 Mar.PMID: 24651265
-
Bieli D, Kanca O, Requena D, Hamaratoglu F, Gohl D, Schedl P, Affolter M, Slattery M, Müller M, Estella C. Establishment of a Developmental Compartment Requires Interactions between three Synergistic Cis-regulatory Modules. PLoS Genet. 2015 Oct 15;11(10):e1005376. doi: 10.1371/journal.pgen.1005376. PMID:26468882; PMCID: PMC4607503.
-
Díaz-García S, Baonza A. Pattern reorganization occurs independently of cell division during Drosophila wing disc regeneration in situ. Proc Natl Acad Sci U S A. 2013 Aug 6;110(32):13032-7. doi: 10.1073/pnas.1220543110. Epub 2013 Jul 22.PMID: 23878228




















