Tumorigénesis y regeneración en Drosophila
Resumen de Investigación:
Nuestro trabajo se ha centrado en el estudio de dos procesos, la regeneración y la tumorigénesis, y en particular en el papel de la ruta se señalización de la quinasa N-terminal de Jun (JNK), una ruta que está muy conservada y que está asociada con la tumorigénesis y la regeneración en metazoos. El sistema modelo que empleamos para estos estudios es Drosophila melanogaster.
La vía de señalización de la JNK es uno de los activadores más importantes de la apoptosis en Drosophila cuya señalización autocrina está implicada en la eliminación de células dañadas o aberrantes. En esta función proapoptótica está incluido el mecanismo de competición celular por el cual se eliminan las células oncogénicas que pueden aparecer durante el desarrollo. Trabajos recientes han demostrado que la JNK también tiene otra función proliferativa, mediada por la señalización paracrina asociada con la actividad de las vías de JAK / STAT, Wingless (Wg) y Decapentaplegic (Dpp).
Con respecto al papel de la función de la JNK en tumorigénesis, hemos demostrado que es un factor importante en el proceso. En publicaciones anteriores (Ballesteros-Arias et al 2014) ya propusimos que las señales proliferativas mediadas por JNK son las responsables del crecimiento de tumores generados por mutaciones oncogénicas. Un trabajo más reciente (Pinal et al 2018) ha demostrado en detalle el potencial tumorigénico de JNK: en ausencia de apoptosis, un estrés transitorio (por ejemplo, radiación ionizante) resulta en la actividad persistente de JNK y de JAK/Stat, Wg o Dpp. El resultado final es una continua señalización proliferativa paracrina, que provoca un crecimiento de los tumores. Además, hemos encontrado que la actividad persistente de JNK después de la irradiación se debe al mantenimiento de un bucle que incluye a especies reactivas de oxígeno (ROS) y al factor de maduración DUOX Moladiev (Mol). Es la presencia de este bucle el que hace que la ausencia de apoptosis sea potencialmente tumorigénica. Actualmente, estamos estudiando los genes responsables de la respuesta tumorigénica que son activados por la vía JNK; en una reciente búsqueda utilizando RNAseq realizada en nuestro laboratorio hemos encontrado posibles candidatos activados por JNK algunos de los cuales están conservados y asociados a cánceres humano.
Estamos también estudiando el papel de JNK en los procesos tumorigénicos producidos por mutaciones como scribble, erupted o polihomeotic. Estas mutaciones, que están conservadas en humanos, alteran la polaridad ápico-basal, la endocitosis o la identidad de las células epiteliales. No se conocen los mecanismos por los cuales alteraciones en estas diferentes vías producen tumores.
Además, estamos investigando el mecanismo de activación de JNK durante la competición celular que aún no está claro. Se conocen algunos de los factores upstream (flor, sas / ptpd10, spz / toll, azot) aunque no sus funciones moleculares específicas. Es posible que existan otras formas de activar JNK.
La via de señalización de la JNK tiene también una función paracrina en procesos de regeneración. Estamos estudiando el potencial regenerativo de los distintos discos imaginales (o regiones de los mismos) en relación con la actividad local de la JNK. Hemos comparado el potencial regenerativo de la región del disco que forma el cuerpo (tórax) respecto a la que forma los apéndices (ala). Hemos observado que la región de ala posee una alto potencial regenerativo del que carece la región de tronco. Nuestros resultados sugieren que esta diferencia está basada en la distinta actividad de la via JNK, cuyos genes diana son distintos en el tronco y el apéndice. Esta observación puede resultar interesante para intentar resolver uno de los problemas clásicos en el campo de la regeneración: el por qué unos órganos tienen mayor capacidad de regeneración que otros o por qué diferentes grupos de animales regeneran de manera distinta.
Además, hemos demostrado que la respuesta proliferativa necesaria para la regeneración está mediada por la actividad JNK que emana de las células dañadas. Es interesante señalar que las regiones del disco de ala que van a formar el tronco y el apéndice provienen de linajes celulares diferentes y por lo tanto no pueden reprogramarse para sustituir uno al otro (Martin et al 2017; Martin and Morata 2018).
Otro de los intereses del laboratorio es el estudio de la remodelación que ocurre en la cromatina durante el proceso de regeneración. Las células que sobreviven al daño tisular deben readaptar su estado para formar el nuevo tejido. Esto lo consiguen remodelando su cromatina para ser capaces de activar o reprimir una nueva batería de genes. Recientemente se ha publicado que en embriones de ratón los retrotransposones de la familia LINE juegan un papel muy importante regulando la accesibilidad global de la cromatina al comienzo del desarrollo (Jachowicz et al 2018) sugiriendo que la activación de retrotransposones es parte integral del programa de desarrollo temprano. Estamos interesados en estudiar si durante la regeneración, la cromatina nuclear podría estar adquiriendo un estado “intermedio” que se asemeje al estado totipotente de los embriones tempranos y que esté mediada por retrotransposones.
Resultados preliminares en el laboratorio indican que los retrotransposones Roo y F-Element de Drosophila sufren profundos cambios en sus niveles durante las primeras horas de desarrollo embrionario. Estamos midiendo los niveles de dichos transposones durante los procesos de regeneración asi como alterando artificialmente los mismos para estudiar su posible función en regeneración.
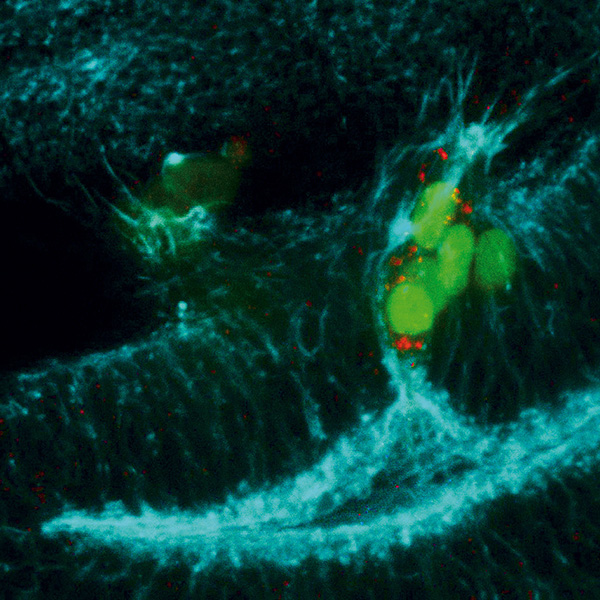
Disco de ala de Drosophila que contiene un clon (verde) deficiente para los genes pro-apoptóticos y que sobreexpresa la vía JNK. Las células del clon sintetizan metaloproteasa 1 (rojo), que degrada la matriz extracelular. Se observan protrusiones de F-actina (azul) en la región basal de las células.
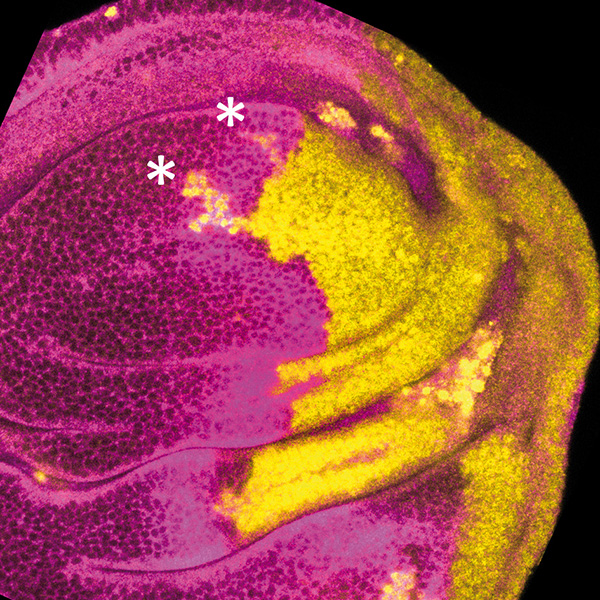
Disco imaginal de ala en el que las células del compartimento posterior (parte derecha) han sufrido un tratamiento de 2 días de inducción de apoptosis y 3 de recuperación. Las células pertenecientes al linaje posterior están marcadas en amarillo, mientras que en magenta se marcan las células del compartimento anterior. Nótese la presencia de grupos de células (asteriscos) que habiéndose originado en el compartimento posterior ahora forman parte del compartimento anterior. Este resultado sugiere que el tratamiento de ablación provoca un colapso transitorio del borde de compartimentos acompañado de un cambio de identidad celular.

| Apellidos | Nombre | Laboratorio | Ext.* | Categoría profesional |
|---|
Publicaciones relevantes:
- Javier Menendez; Ainhoa Perez-Garijo; Manuel Calleja; Ginés Morata. 2010. A tumour-suppressing mechanism in Drosophila involving cell competition and the Hippo pathway. PNAS 107 14651-14656.
- Ginés Morata; Evgeny Shlevkov; Ainhoa Perez-Garijo. 2011. Mitogenic signalling from apoptotic cells in Drosophila. Development, Growth and Differentiation 53, 168-176.
- Eveny Shlevkov; Ginés Morata. 2012. A p53-JNK-dependant feedback amplification loop is essential for the apoptotic response in Drosophila. Cell Death & Differentiation 19, 451-460.
- Salvador C Herrera; Raquel Martin; Ginés Morata, G. 2013. Tissue homeostasis in the wing disc of Drosophila: immediate response to massive damage during development. PLoS Genet 9 (4) e10034446.
- Luna Ballesteros-Arias; Veronica Saavedra Ginés Morata. 2014. Cell competition may function either as tumour-suppressing or as tumour-stimulating factor in Drosophila. Oncogene 33, 4377-4384.
- Salvador C Herrera; Ginés Morata G. 2014. Transgressions of compartment boundaries and cell reprogramming during regeneration of the imaginal discs of Drosophila. eLife. 01831.
- Cantero, W., Zaballos, M.A. N. Azpiazu (2015). The Hox/TALE transcription factor Homothorax functions to assemble constitutive heterochromatin during Drosophila embryogenesis. PLoS ONE 10(3):e0120662. doi:10.1371/journal.pone.0120662
- Ginés Morata; Salvador C Herrera. 2016. Cell reprogramming during regeneration in Drosophila: transgression of compartment boundaries. Current Opinion in Genetics & Development 40, 11-16.
- Antonio Montes; Ginés Morata. 2017. Homeostatic response to blocking cell division in Drosophila imaginal discs: role of the Fat/Dachsous (Ft/Ds) pathway. Dev. Biol 424, 113-123.
- Raquel Martin; Noelia Pinal; Ginés Morata, G. 2017. Regeneration potential of the trunk and the appendages of Drosophila meditated by JNK signalling. Development 144, 3946-3956.
- Noelia Pinal; Maria Martin; Izarne Medina; Ginés Morata G. 2018. Short-term activation of the Jun-N terminal Kinase pathway in apoptosis-deficient cells of Drosophila induces tumorigenesis. Nature Communi. 9(1), 1541.
- N. Azpiazu D. Blom-Dah . 2018 “The Pax protein Eyegone (Eyg) interacts with the pi- RNA component Aubergine (Aub) and controls egg chamber development in Drosophila” Dev. Bio 434, 267-277.
- Noelia Pinal; Manuel Calleja; Ginés Morata. 2019. Pro-apoptotic and pro-proliferation functions of the JNK pathway of Drosophila: roles in cell competition, tumourigenesis and regeneration. Open Biol. 9 (3), DOI: 10.1098/rsob.180256
- Manuel Calleja; Ginés Morata. 2019. Cell competition and tumorigenesis in the imaginal discs of Drosophila. Semin. Cancer Biol. DOI:10.1016/j.semcancer.2019.06.010
Tesis doctorales:
- Evgeny Shlevklov (2011) Nuevos mecanismos de regulación de la apoptotis en Drosophila melanogaster. Universidad Autónoma de Madrid. Director: Ginés Morata Pérez.
- Javier Ménendez González (2011) Competición celular y desarrollo de tumores en discos imaginales de Drosophila. Universidad Autónoma de Madrid. Director: Ginés Morata Pérez.
- Salvador C. Herrera (2013) Respuesta homeostática e inducción de cambios de identidad tras ablaciones en Drosophila melanogaster. Universidad Autónoma de Madrid. Director: Ginés Morata Pérez.
- Luna Laura Ballesteros Arias (2016)The role of cell competition in tumour initiation and progression in Drosophila melanogaster . Universidad Autónoma de Madrid. Director: Ginés Morata Pérez.
- María Martin Montero (2016) La apoptosis como factor promotor de tumorogenésis en Drosophila melanogaster. Universidad Autónoma de Madrid. Director: Ginés Morata Pérez.
- Antonio Jóse Montes Ruiz (2016) Control del crecimiento en los discos imaginales de Drosophila melanogaster. Universidad Autónoma de Madrid. Director: Ginés Morata Pérez.
Premios y distinciones:
- Ginés Morata. Prince of Asturias Prize in Science and Technology, 2007/Premio Príncipe de Asturias de Ciencia y Tecnología 2007
- Ginés Morata. Honorary Doctorate by the Universidad de Alcalá, 2007/Doctorado Honoris Causa por la Universidad de Alcalá, 2007
- Ginés Morata. Honorary Doctorate by the Universidad de Almeria, 2008/Doctorado Honoris Causa por la Universidad de Almería, 2008
- Ginés Morata. National Prize of Genetics, 2015/Premio Nacional de Genética 2015
- Ginés Morata. Science Award (shared with P.A. Lawrence) Centenary Awards of the BritishSpanish Society 1916-2016/Premio (compartido con Peter Lawrence) del Centenario de la Sociedad Hispano Británica
- Ginés Morata. Foreign Member of the Royal Society, 2017/Miembro extranjero de la Royal Society
- Ginés Morata. Foreign Member of the US National Academy of Sciences, 2018/ Miembro extranjero de la Academia Nacional de Ciencias de USA




















