Transmisión de señales a través del receptor para el antígeno de células T
Resumen de Investigación:
La activación del linfocito T requiere del reconocimiento de un péptido antigénico unido a MHC (pMHC) por el receptor de antígeno de la célula T (TCR). El TCR contacta con el antígeno de forma extracelular a través de sus cadenas variables α y β; al tener éstas colas citoplasmáticas muy cortas, hace que el inicio de la señal sea a través de la subunidad CD3, que posee colas más largas que les permite realizar interacciones intracelulares. Hemos descubierto que el TCR está organizado en la membrana plasmática de las células T en reposo como oligómeros de hasta 20 TCR que hemos denominado nanoclusters de TCR. Creemos que la organización del TCR en nanoclusters puede explicar en parte la alta sensibilidad de las células T para el antígeno a pesar de la baja afinidad del TCR monovalente para pMHC. De hecho, recientemente hemos descubierto que el nanoclustering de TCR permite fenómenos de cooperatividad entre TCRs comprometidos y no comprometidos con pMHC. Además, hemos propuesto que los cambios conformacionales median la conversión de contactos pMHC-TCR en señales intracelulares impulsadas por CD3, lo que desencadena el TCR. Una de las consecuencias del cambio conformacional en el TCR es la exposición de una secuencia rica en prolina (PRS) de CD3ε que está disponible para unirse a la proteína adaptadora Nck. Hemos desarrollado inhibidores de bajo peso molecular del reclutamiento de Nck al TCR como agentes inmunomoduladores. Estos inhibidores están disponibles por vía oral y muestran un potente efecto profiláctico y terapéutico en diferentes modelos de enfermedades autoinmunes, al tiempo que evitan la respuesta de las células T a los patógenos. Otro efector directo del TCR es la pequeña GTPasa RRas2 (también conocida como TC21), que se une constitutivamente al TCR no fosforilado y juega un papel importante en la señalización homeostática a través de PI3K. Estamos estudiando el papel de RRas2 en los procesos fisiológicos de los linfocitos T y B, como el control homeostático de las poblaciones, la formación de la sinapsis inmunológica, la selección tímica, la formación del centro germinal, así como en procesos patológicos como la formación de linfomas y leucemias de células T y B. Nuestros hallazgos recientes más interesantes sugieren que RRas2 es un impulsor oncogénico en la generación de leucemias linfocíticas crónicas y en algunos tipos de cáncer de mama. RRas2 impulsa la generación de cáncer en ausencia de mutaciones activadoras que son comunes en KRas y otras Ras GTPasas clásicas.
Estamos tratando de descubrir los mecanismos y la relevancia de RRas2 para el cáncer en humanos.
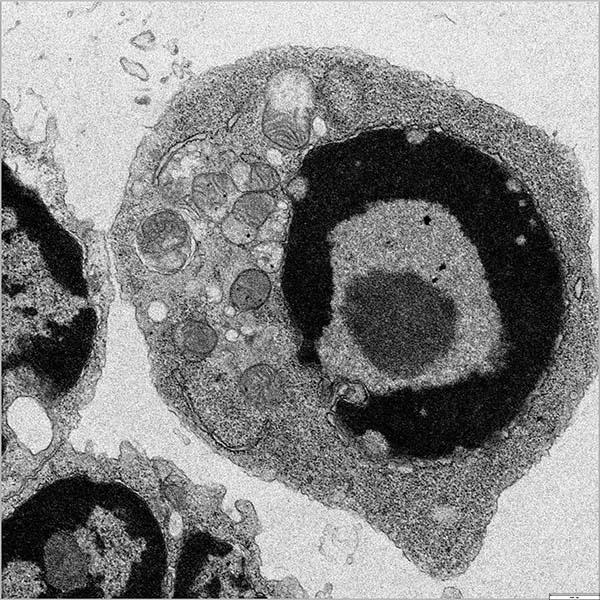
Figura 1. Morfología alterada de las mitocondrias que exhiben pocas crestas y poco diferenciadas en las células B del centro germinal de ratones con deficiencia de Rras2.
Escala = 500 nm.
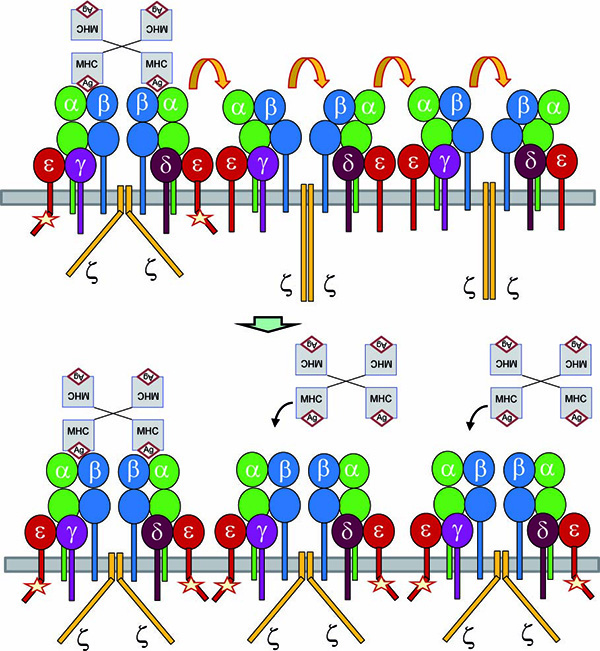
Figura 2. Efecto cooperativo sobre la unión del ligando pMHC con TCR nanoclusters. La unión del tetrámero pMHC a dos TCR dentro de un nanocluster promueve la adopción de la conformación activa por todos los TCR en el grupo. La conformación activa facilita la unión posterior de pMHC a los TCR no unidos.

| Apellidos | Nombre | Laboratorio | Ext.* | Categoría profesional | |
|---|---|---|---|---|---|
| Alarcón Sánchez | Balbino | 221 | 4555 | balarcon(at)cbm.csic.es | E. Profesores de Investigación de Organismos Públicos de Investigación |
| Arellano Rojo | Irene Azahara | 221 | 4600 | iarellano(at)cbm.csic.es | M3 |
| Blanco Ferreras | Valentina | 221 | 4600 | vblanco(at)cbm.csic.es | E.Auxiliares De Invest. De Los Oo.Publicos De Investigacion |
| Borroto Revuelta | Aldo Jorge | 221 | 4600 | aborroto(at)cbm.csic.es | Doctor |
| Cifuentes Caballero | Claudia | 221 | 4600 | c.cifuentes(at)cbm.csic.es | M3 |
| Gómez Aranda | Tania Alejandra | 221 | 4600 | tgomez(at)cbm.csic.es | Ayudante Investigación |
| Hortal Borowski | Alejandro Miguel | 221 | 4600 | ahortal(at)cbm.csic.es | M2 |
| Howells | Leonie Alexandra | 221 | 4600 | Estudiante | |
| Lombard | Alice Marie Stephanie | 221 | 4600 | alombard(at)cbm.csic.es | M3 Predoc.formación |
| Tercero Malo | Rut | 221 | 4600 | rtercero(at)cbm.csic.es | Titulado Sup. Actividades Tecn. y Prof.GP1 |
Publicaciones relevantes:
- A. Borroto, D. Reyes-Garau, M. A. Jiménez, E. Carrasco, B. Moreno, S. Martínez-Pasamar, J. R. Cortés, A. Perona, D. Abia, S. Blanco, M. Fuentes, I. Arellano, J. Lobo, H. Heidarieh, J. Rueda, P. Esteve, D. Cibrián, A. Martinez-Riaño, P. Mendoza, C. Prieto, E. Calleja, C. L. Oeste, A. Orfao, M. Fresno, F. Sánchez-Madrid, A. Alcamí, P. Bovolenta, P. Martín, P. Villoslada, A. Morreale, A. Messeguer, & B. Alarcon. (2016). First-in-class inhibitor of the T-cell receptor for the treatment of autoimmune diseases. Sci Transl Med 8(370):370ra184. doi: 10.1126/scitranslmed.aaf2140. Classified as of Special Significance in its field by Faculty of 1000.
- Pilar Mendoza, Nuria Martínez-Martín, Elena R. Bovolenta, Diana Reyes-Garau, Pablo Hernansanz-Agustín, Pilar Delgado, Manuel D. Diaz-Muñoz, Clara L. Oeste, Isabel Fernández-Pisonero, Ester Castellano, Antonio Martínez-Ruiz, Diego Alonso-Lopez, Eugenio Santos, Xosé R. Bustelo, Tomohiro Kurosaki, & Balbino Alarcón. (2018). RRas2 is required for germinal center formation to aid B cells during energetically demanding processes. Science Signaling 11, eaa1506. doi: 10.1126/scisignal.aal1506
- Martin-Blanco N, Blanco R, Alda-Catalinas C, Bovolenta ER, Oeste CL, Palmer E, Schamel WW, Lythe G, Molina-París C, Castro M, Alarcon B. (2018). A window of opportunity for cooperativity in the T Cell Receptor. Nat Commun. 9(1):2618. doi: 10.1038/s41467-018-05050-6
- Martínez-Riaño A, Bovolenta ER, Mendoza P, Oeste CL, Martín-Bermejo MJ, Bovolenta P, Turner M, Martínez-Martín N, Alarcón B. (2018). Antigen phagocytosis by B cells is required for a potent humoral response. EMBO Rep. 19(9). pii: e46016. doi: 10.15252/embr.201846016
- Martínez-Riaño A, Bovolenta ER, Boccasavia VL, Ponomarenko J, Abia D, Oeste CL, Fresno M, van Santen HM and Alarcon B. (2019). RRAS2 shapes the TCR repertoire by setting the threshold for negative selection. J Exp Med. Jul 19. pii: jem.20181959. doi: 10.1084/jem.20181959
Tesis doctorales:
- Pilar Mendoza Daroca (2016). La GTPasa RRas2 regula la demanda energética de los linfocitos B durante la reacción de centro germinal. Universidad Autónoma de Madrid. Director: Balbino Alarcón.
- Ana Martínez Riaño (2017). B cell receptor-dependent antigen phagocytosis drives the germinal center response in vivo and in vitro. Universidad Autónoma de Madrid. Director: Balbino Alarcón.
- Enrique Calleja Sierra (2017). Regulación de la actividad de la GTPasa RRas2 por interacción directa con los receptores de antígeno. Universidad Autónoma de Madrid. Director: Balbino Alarcón.
- Viola Lucrezia Boccasavia (2018). Relevance of antigen presentation by T cells on T cell differentiation. Universidad Autónoma de Madrid. Director: Balbino Alarcón.
- Elena Rodríguez Bovolenta (2018). Regulation of pre-TCR and TCR function by the transmembrane domain of CD3ζ chain during T cell development. Universidad Autónoma de Madrid. Director: Balbino Alarcón.




















