Estudios fisiopatológicos y desarrollo de terapias en modelos animales y celulares de enfermedades neurometabólicas
Resumen de Investigación:
El grupo pertenece al CIBER de Enfermedades Raras (CIBERER) y al Instituto de Investigación Sanitaria IdiPAZ y colabora activamente con el Centro de Diagnóstico de Enfermedades Moleculares (CEDEM, Facultad de Ciencias, UAM). Nuestro trabajo se centra en enfermedades neurometabólicas, entre ellas la acidemia propiónica (AP) y las hiperfenilalaninemias, deficiencias enzimáticas de herencia autosómica recesiva que se caracterizan por la acumulación tóxica de precursores y de sus derivados y la falta de metabolitos posteriores.
Nuestro proyecto representa un estudio traslacional con el objetivo de generar y caracterizar modelos celulares y animales relevantes de enfermedad como herramientas de investigación para comprender los mecanismos moleculares y fisiopatológicos de enfermedad, analizar biomarcadores potenciales para el pronóstico y el seguimiento, así como identificar nuevas dianas terapéuticas. El objetivo final es el desarrollo de terapias personalizadas dirigidas al RNA (oligonucleótidos antisentido) así como terapias farmacológicas con compuestos antioxidantes y activadores mitocondriales, mediante la realización de estudios preclínicos en los modelos específicos de cada enfermedad.
El grupo de investigación tiene una larga experiencia en el uso de la terapia antisentido in vitro e in vivo para corregir mutaciones de splicing en diferentes enfermedades raras, incluidas las hiperfenilalaninemias, participando en Acciones EU-COST con esa temática. Actualmente, estamos aplicando la técnica de edición génica CRISPR/Cas9 para generar modelos celulares y animales con mutaciones de splicing específicas, con objeto de identificar y testar oligonucleótidos antisentido terapéuticos.
Por otra parte, nos hemos centrado en el estudio de la fisiopatología de la acidemia propiónica (AP), una de las acidemias orgánicas más frecuentes en la que hemos demostrado, utilizando un modelo murino, la contribución de la disfunción mitocondrial, el estrés oxidativo y la desregulación de miRNAs a las alteraciones multiorgánicas de la enfermedad. Hemos revelado la alteración en el manejo del Ca2+, asociado a niveles elevados de ROS y de SERCA2a oxidada, así como la desregulación de cardiomiRs específicos, como mecanismos implicados en el desarrollo de cardiomiopatías en AP. También es importante señalar que hemos demostrado el efecto beneficioso del tratamiento con antioxidantes (resveratrol, MitoQ) tanto a nivel in vitro (fibroblastos de pacientes) como in vivo (modelo murino) y se están testando otros antioxidantes y activadores de la biogénesis mitocondrial. Hemos generado células iPS derivadas de fibroblastos de pacientes y diferenciado a neuronas y a cardiomiocitos, linajes celulares relevantes en la enfermedad, para estudios fisiopatológicos y de análisis de terapias génicas y farmacológicas.
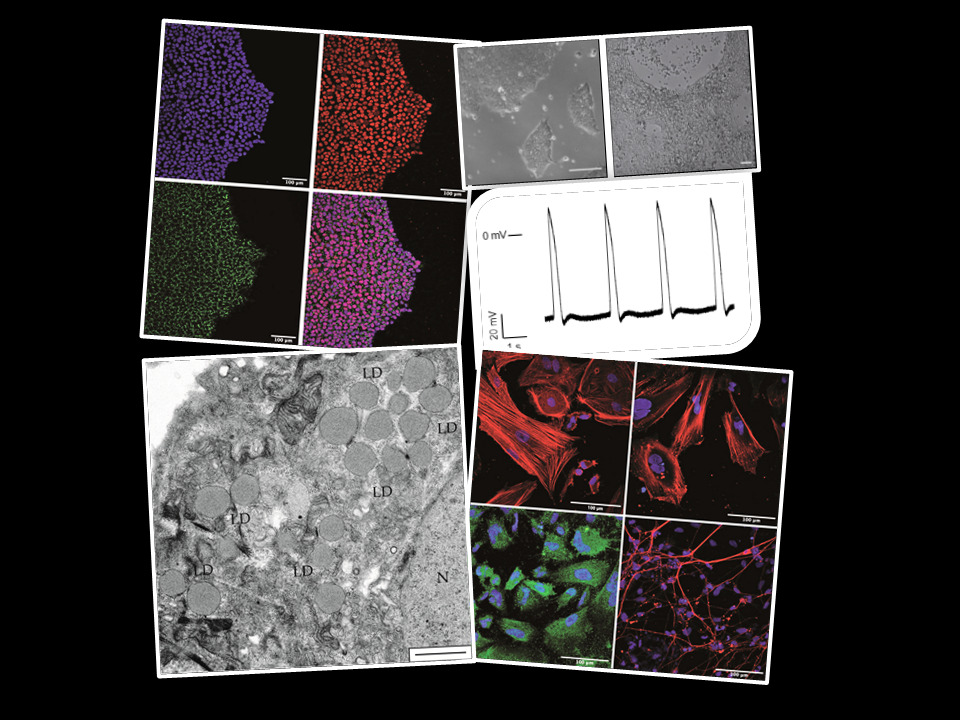
Figura 1. Generación de distintos modelos celulares derivados de iPSCs a partir de fibroblastos de pacientes con acidemia propiónica.
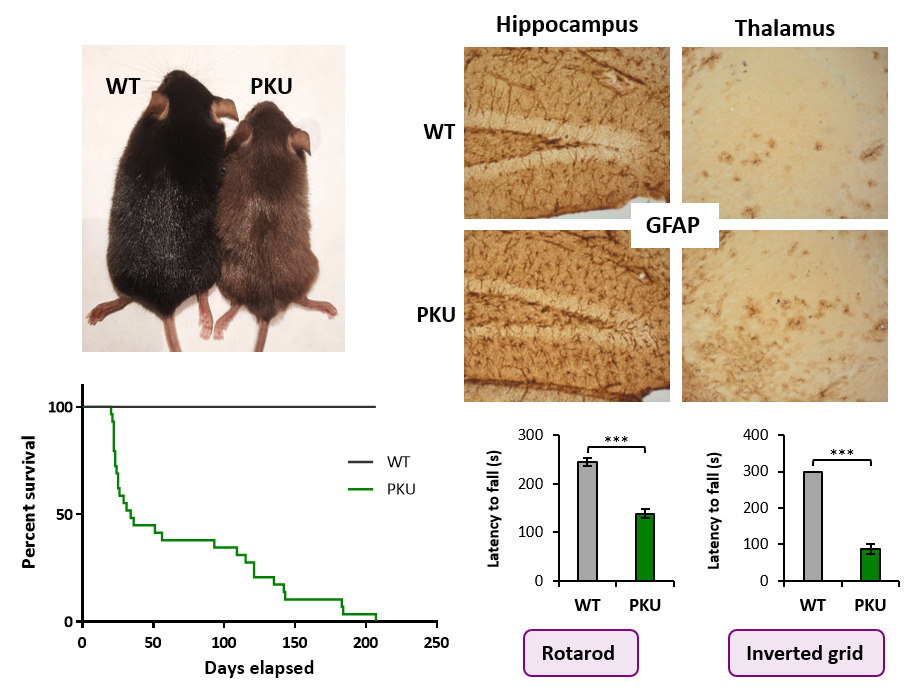
Figura 2. Nuevo modelo de ratón PKU humanizado generado mediante CRISPR/Cas9 portador de la variante de splicing c.1066-11G>A.

| Last Name | Name | Laboratory | Ext.* | Professional category | |
|---|---|---|---|---|---|
| Alvera Alonso | Beatriz | 220 | 4566 | Estudiante TFG | |
| Álvarez García | María del Mar | 220 | 4596 | malvarez(at)cbm.csic.es | E. Técnicos Superiores Especializados de Organismos Públicos de Investigación |
| González Garnacho | Irene | 220 | 4596 | Estudiante TFG | |
| Martínez Pizarro | Ainhoa | 220 | 4596/7830 | ainhoa.martinez(at)cbm.csic.es | Titulado Sup.de Actividades Técn. y Profes. GP1 |
| Montalvo de la Prida | Elena | 220 | 4596/7830 | emontalvo(at)cbm.csic.es | Tco. de Investigación y Laboratorio |
| Richard Rodríguez | Eva María | 220 | 4628/4596 | erichard(at)cbm.csic.es | Profesor Titular Universidad, GA |
| Ruiz Desviat | Lourdes | 220 | 4566/7830 | lruiz(at)cbm.csic.es | Catedrática |
Publicaciones relevantes:
- Martínez-Pizarro A, Leal F, Holm LL, Doktor TK, Petersen USS, Bueno M, Thöny B, Pérez B, Andresen BS, Desviat LR. (2022) Antisense oligonucleotide rescue of deep-intronic variants activating pseudoexons in the 6-Pyruvoyl-Tetrahydropterin Synthase gene. Nucleic Acid Ther. Jul 12. doi: 10.1089/nat.2021.0066
- Soria LR, Makris G, D'Alessio AM, De Angelis A, Boffa I, Pravata VM, Rüfenacht V, Attanasio S, Nusco E, Arena P, Ferenbach AT, Paris D, Cuomo P, Motta A, Nitzahn M, Lipshutz GS, Martínez-Pizarro A, Richard E, Desviat LR, Häberle J, van Aalten DMF, Brunetti-Pierri N. (2022). O-GlcNAcylation enhances CPS1 catalytic efficiency for ammonia and promotes ureagenesis. Nat Commun Sep 5;13(1):5212.
- López Márquez A, Martinez PizarroA, Pérez B, Richard E, Desviat LR. (2022). “Modelling splicing variants amenable to antisense therapy by use of CRISPR-Cas9 based gene editing in HepG2 cells”. Series: Methods Mol Biol. “Antisense RNA design, delivery and analysis”. Arechavala-Gomeza V and Garanto A, eds Springer. Capítulo 10. Pag 167-184. ISSN 1064-3745.
- Alonso-Barroso E, Pérez B, Desviat LR and Richard E. (2021). “Cardiomyocytes derived from induced pluripotent stem cells as a disease model for propionic acidemia”. Int J Mol Sci 22: 1161-1175.
- Hammond SM, Aartsma-Rus A, Alves S, Borgos SE, Buijsen RAM, Collin RWJ, Covello G, Denti MA, Desviat LR, Echevarría L, Foged C, Gaina G, Garanto A, Goyenvalle AT, Guzowska M, Holodnuka I, Jones DR, Krause S, Lehto T, Montolio M, Van Roon-Mom W, Arechavala-Gomeza V. (2021) Delivery of oligonucleotide-based therapeutics: challenges and opportunities. EMBO Mol Med.13(4):e13243.
- Fulgencio-Covián A, Álvarez M, Pepers BA, López-Márquez A, Ugarte M, Pérez B, van Roon-Mom WMC, Desviat LR, Richard E*. (2020). “Generation of a gene-corrected human isogenic line (UAMi006-A) from propionic acidemia patient iPSC with an homozygous mutation in the PCCB gene using CRISPR/Cas9 technology”. Stem Cell Res 49:102055.
- Park KC, Krywawych S, Richard E, Desviat LR, Swietach P. (2020). “Cardiac complications of propionic and other inherited organic acidemias”. Front Cardiovasc Med 7, 1-20.
- Fulgencio-Covián A, Alonso-Barroso E, Guenzel AJ, Rivera-Barahona A, Ugarte M, Pérez B, Barry MA, Pérez-Cerdá C, Richard E, Desviat LR. (2020) Pathogenic implications of dysregulated miRNAs in propionic acidemia related cardiomyopathy. Transl Res. Apr;218:43-56.
- Tamayo M, Fulgencio-Covián A, Navarro-García JA, Val-Blasco A, Ruiz-Hurtado G, Gil-Fernández M, Martín-Nunes L, Lopez JA, Desviat LR, Delgado C, Richard E, Fernández-Velasco M (2020) Intracellular calcium mishandling leads to cardiac dysfunction and ventricular arrhythmias in a mouse model of propionic acidemia Biochim Biophys Acta Mol Basis Dis. Jan 1;1866(1):165586




















