La acidemia propiónica es una enfermedad rara o poco frecuente, causada por mutaciones que afectan la actividad de la proteína mitocondrial propionil-CoA carboxilasa. El mal funcionamiento de esta enzima provoca la acumulación de metabolitos tóxicos, como el propionil-CoA, que pueden dañar órganos vitales, especialmente el corazón. Aunque se conoce desde hace décadas que la acidemia propiónica puede provocar arritmias y cardiomiopatías graves, los mecanismos que conducen a estas alteraciones aún no están claros.
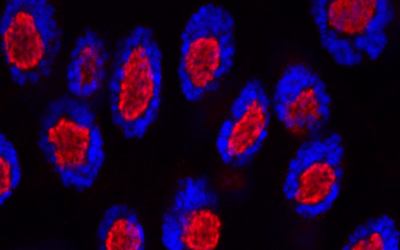
Para abordar esta cuestión, los equipos liderados por Eva Richard, Lourdes R. Desviat, en el Centro de Biología Molecular Severo Ochoa (CBM-CSIC-UAM), en colaboración con Guofang Zhang, de Duke University (Durham, EE.UU.), utilizaron células madre pluripotentes inducidas derivadas de un paciente con la enfermedad para producir células de corazón (cardiomiocitos), y los compararon con células sanas. Mediante técnicas avanzadas de análisis metabólico lograron rastrear en tiempo real el destino de distintos compuestos del metabolismo celular.
Uno de los hallazgos clave fue la identificación de una vía alternativa de defensa celular. Cuando el metabolito propionil-CoA se acumula, las células lo convierten en propionilcarnitina y propionato, este último siendo expulsado fuera de la célula como una especie de “válvula de presión”. Este mecanismo protector no se había descrito previamente y podría ayudar a mitigar el daño celular.
Sin embargo, este sistema de defensa no es suficiente para evitar la disfunción cardíaca. El estudio, publicado en la revista Cellular and Molecular Life Sciences, reveló que la acumulación de propionil-CoA induce un cambio en el metabolismo energético del corazón. Normalmente, los cardiomiocitos obtienen su energía de la oxidación de ácidos grasos, un proceso altamente eficiente. En cambio, en las células derivadas del paciente con acidemia propiónica, se observó una transición hacia un metabolismo basado en glucosa, un combustible menos eficiente. Esta “reprogramación metabólica” podría explicar la progresiva pérdida de capacidad contráctil del corazón y su vulnerabilidad en estos pacientes.
“Este cambio en el uso de combustibles energéticos podría ser un factor clave en el deterioro progresivo del corazón en pacientes con acidemia propiónica”, explica la Dra. Eva Richard, investigadora del CBM y una de las autoras principales del estudio. Además, destaca la importancia de los modelos celulares derivados de pacientes: “Este tipo de enfoques personalizados nos permite observar directamente qué ocurre en un modelo celular humano, algo que no siempre se puede reproducir en modelos animales”.
Estos hallazgos no solo mejoran la comprensión de la enfermedad, sino que también abren nuevas líneas de investigación para el desarrollo de terapias dirigidas. Si se logra fortalecer el metabolismo mitocondrial o evitar el cambio de sustrato energético, podrían diseñarse tratamientos más efectivos para prevenir o retrasar el daño cardíaco en pacientes con acidemia propiónica.
El estudio ha sido posible gracias al apoyo de la Propionic Acidemia Foundation (EE.UU.), la Fundación Ramón Areces y el Ministerio de Ciencia, Innovación y Universidades.
Referencia
Metabolic flux analysis in hiPSC‑CMs reveals insights into cardiac dysfunction in propionic acidemia. Eva Richard, Hannah Marchuk, Mar Álvarez, Wentao He, Xiaoxin Chen, Lourdes R. Desviat, Guo‑Fang Zhang. Cellular and Molecular Life Sciences (2025) 82:137. DOI: https://doi.org/10.1007/s00018-025-05661-5
Contacto
CBM Comunicación – comunicacion@cbm.csic.es