Un equipo de investigadores ha identificado una nueva variante genética responsable de hiperplexia, también conocida como síndrome del sobresalto o síndrome del bebé entumecido, una enfermedad neurológica poco frecuente que afecta a recién nacidos y lactantes. El estudio, liderado por Beatriz López Corcuera en el Centro de Biología Molecular Severo Ochoa (CBM-CSIC-UAM), en colaboración con otros centros de investigación y hospitales de España y Reino Unido, ha revelado un mecanismo patológico nuevo en esta condición.
La hiperplexia se manifiesta en bebés con síntomas como rigidez muscular (hipertonía) y reacciones de sobresalto exageradas ante estímulos suaves como un sonido o un leve contacto físico. En los casos más graves, puede provocar episodios de apnea, es decir, pausas respiratorias prolongadas que pueden poner en riesgo la vida del paciente. Esta enfermedad está causada por un mal funcionamiento en la señalización inhibitoria del sistema nervioso, y en particular, en la acción de la glicina, un neurotransmisor fundamental para el control de los movimientos.
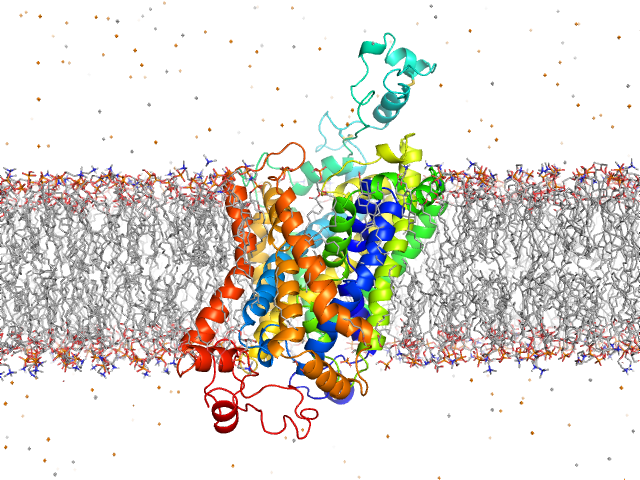
Hasta ahora se sabía que mutaciones en algunos genes que regulan la función de la glicina podían dar lugar a esta enfermedad. Uno de ellos es el gen SLC6A5, que codifica una proteína llamada GlyT2, responsable de transportar glicina a las neuronas. Sin este transportador, la glicina no puede cumplir su función correctamente, lo que provoca los síntomas característicos de la hiperplexia.
Un mecanismo patológico doble: pérdida de función y efecto tóxico
El equipo ha identificado una nueva mutación en el gen SLC6A5 en un paciente diagnosticado con hiperplexia. Gracias a un enfoque experimental multidisciplinar, los investigadores demostraron que esta variante genética anula la función del transportador GlyT2, impidiendo que la glicina llegue al lugar adecuado en las células nerviosas. Sin embargo, el descubrimiento más sorprendente fue que la mutación no solo provoca una pérdida de función, sino que introduce un nuevo comportamiento dañino en la proteína mutante.
Según los investigadores, esta proteína alterada interactúa de forma anómala con los lípidos de la membrana celular, lo que provoca su acumulación en zonas especializadas de la membrana llamadas “balsas lipídicas”. Esta acumulación genera estrés en el retículo endoplásmico, una señal de alarma celular que afecta el funcionamiento general de la célula, y altera la organización del citoesqueleto de actina, que es esencial para mantener la forma y estabilidad de las neuronas.
“Este mecanismo patogénico no había sido descrito antes en casos de hiperplexia. Descubrimos que la proteína mutante no solo deja de hacer su trabajo, sino que además ‘molesta’ a la célula de nuevas maneras, afectando su estructura interna y generando estrés celular”, explicó el investigador Jorge Sarmiento-Jiménez, primer autor del estudio.
Hacia tratamientos más personalizados
El hallazgo no solo proporciona una comprensión más profunda de cómo se origina esta enfermedad, sino que también podría tener importantes implicaciones clínicas. Al entender exactamente cómo una mutación específica provoca la enfermedad, los investigadores abren la puerta al diseño de estrategias terapéuticas personalizadas, dirigidas a corregir o compensar el defecto molecular concreto de cada paciente.
Este estudio destaca la importancia del análisis detallado de las variantes genéticas y de su impacto funcional en las células. La hiperplexia sigue siendo una enfermedad poco conocida y de difícil diagnóstico. Sin embargo, investigaciones como esta permiten avanzar hacia una medicina más personalizada, basada en la comprensión profunda de los mecanismos moleculares detrás de cada caso.
Referencia
Sarmiento-Jiménez, J., Felipe, R., Núñez, E., Ferrando-Muñoz, A., Benito-Muñoz, C., Gago, F., Vázquez, J., Camafeita, E., Clement, E., Wilson, B., & López-Corcuera, B. (2025). A New GlyT2 Variant Associated with Hyperekplexia. International Journal of Molecular Sciences, 26(14), 6753. https://doi.org/10.3390/ijms26146753