El equipo de Aura Carreira, en el Centro de Biología Molecular Severo Ochoa (CBM, CSIC-UAM), ha dado un paso importante para entender por qué algunas mutaciones del gen BRCA2 pueden impulsar el desarrollo del cáncer de formas mucho más complejas de lo que se pensaba. Hasta ahora, la mayoría de estudios asumían que el riesgo cancerígeno asociado a BRCA2 se debía principalmente a la pérdida total de su función. Sin embargo, este nuevo trabajo muestra que incluso una pérdida parcial o la presencia de una versión incompleta de la proteina ya puede desorganizar procesos celulares esenciales.
BRCA2 es un gen crucial para mantener la estabilidad del ADN. La proteína codificada por este gen se encarga de coordinar la recomposición de roturas en el ADN mediante un mecanismo muy preciso llamado recombinación homóloga, algo así como un sistema de reparación de alta fidelidad. Cuando esta “herramienta” no está o no funciona bien, la célula acumula errores y pueden iniciarse procesos que favorecen la aparición de tumores.
El grupo de Carreira analizó el impacto de dos mutaciones patogénicas de BRCA2, ambas asociadas a riesgo de cáncer de mama. Para ello emplearon células epiteliales mamarias normales, no tumorales, con el fin de reproducir lo que ocurre en un tejido sano antes de que aparezca un tumor.
La primera mutación impedía que BRCA2 produjera su proteína. Es decir, de las dos copias de este gen que tiene cada célula, solo una seguía funcionando. Este escenario se conoce como haploinsuficiencia, y significa que “media dosis” del gen no basta para mantener la reparación del ADN en niveles normales. Las células con esta mutación mostraron una capacidad reducida para reparar roturas del ADN y, además, se volvieron más sensibles a los inhibidores de PARP, un tipo de fármaco utilizado en pacientes de cancer de mama asociado a BRCA2. En la práctica, estas células se quedaban sin opciones eficientes para reparar su ADN, acumulaban daños y se volvían vulnerables. Esto confirma que, incluso sin perder completamente BRCA2, las células ya pueden comportarse de forma problemática y responder de manera distinta a ciertos tratamientos oncológicos.
La segunda mutación fue aún más llamativa. En este caso, el gen producía una proteína truncada, es decir, una versión incompleta de BRCA2. Podría pensarse que algo “a medias” simplemente no funciona, pero aquí ocurre algo peor: esta variante incompleta interfiere con la proteína BRCA2 normal. No solo deja de ayudar, sino que dificulta el trabajo de la proteína BRCA2 intacta.
El estudio reveló además que esta proteína truncada “secuestra” a PCAF, una enzima que regula la acetilación de histonas, unas proteínas que funcionan como carretes alrededor de los cuales se enrolla el ADN. La acetilación, y en particular la de la histona H4, actúa como una marca que abre el ADN para activar genes concretos. Cuando PCAF queda atrapada por la proteína truncada, estas marcas químicas se reducen de manera global.
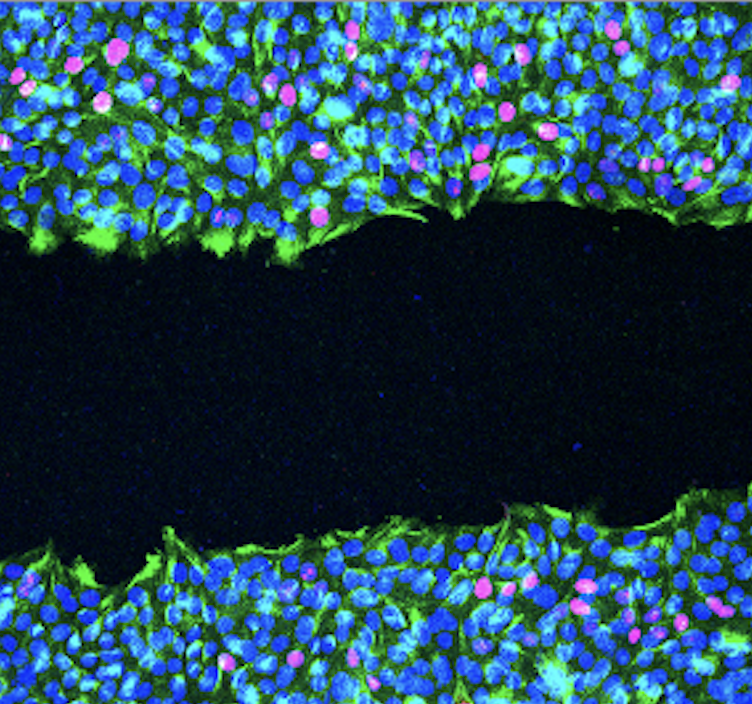
Esto tiene consecuencias profundas: se silencian programas de expresión génica que deberían estar activos y se apaga la señalización NF-κB, una vía que coordina la inflamación, las defensas celulares y la supervivencia ante estrés. Al alterarse esta vía, las células cambian su comportamiento, incluyendo cómo se mueven dentro del tejido (migración epitelial). Estos cambios en movilidad y respuesta al entorno pueden influir directamente en la capacidad de un tumor para avanzar o invadir.
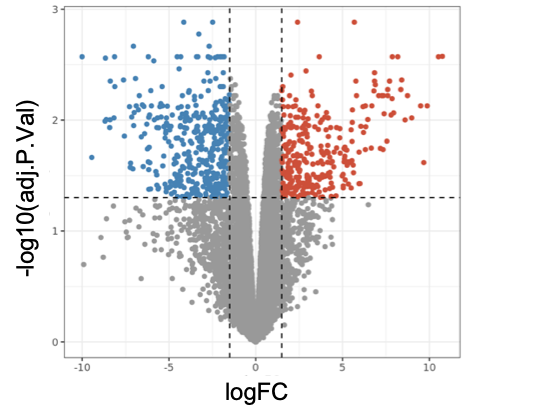
Este gráfico muestra que la mutación patogénica c.5946delT altera la actividad de cientos de genes (azul, subexpresados, rojo, sobreexpresados) con respecto a células epiteliales de mama con expresión de BRCA2 normal. / Aura Carreira, CBM
Los resultados destapan así un nuevo eje BRCA2–PCAF que modula de forma inesperada la actividad de NF-κB y reprograma la expresión de múltiples genes. La idea de que ciertas mutaciones de BRCA2 pueden “reconfigurar” la célula capturando enzimas clave y manipulando redes de señalización añade una capa de complejidad al papel de este gen en el cáncer.
Comprender estos mecanismos abre oportunidades para desarrollar terapias más personalizadas. “Saber qué tipo de mutación de BRCA2 tiene un paciente podría ayudar a predecir su respuesta a ciertos fármacos, como los inhibidores de PARP, y también permitir diseñar estrategias que corrijan o compensen los efectos de la proteína truncada”, indica Carreira.
En conjunto, este trabajo contribuye a una visión más completa y matizada del papel de BRCA2 en la biología del cáncer e impulsa nuevas líneas de investigación hacia tratamientos más precisos y eficaces.
Este trabajo ha sido financiado por una ayuda conjunta de la Worldwide Cancer Research (UK) y la Asociación Española Contra el Cáncer.
Referencia
Minello*, Gomez-Escudero*, Sridhara* et al., Nature Communications. DOI: 10.1038/s41467-025-67209-2