La muerte celular puede parecer un fracaso biológico, pero en realidad es una de las herramientas más sofisticadas de la vida. Cada día, millones de células se autodestruyen de forma controlada mediante un proceso llamado apoptosis, que permite eliminar células dañadas, envejecidas o innecesarias sin causar daño al organismo. Sin este mecanismo, el desarrollo sería imposible y los tejidos acabarían acumulando errores.
La apoptosis funciona gracias a unas proteínas llamadas caspasas, auténticas tijeras moleculares que desmontan la célula desde dentro. Este sistema está tan finamente ajustado que apenas ha cambiado a lo largo de la evolución: los mismos principios operan en insectos y en seres humanos. Por eso, estudiar estos procesos en organismos sencillos como la mosca del vinagre (Drosophila melanogaster) permite entender mecanismos básicos de nuestra propia biología.
Las caspasas actúan en cadena. Primero se activan las caspasas iniciadoras, que dan la orden de empezar, y después las caspasas ejecutoras, que destruyen la célula. En Drosophila, la principal caspasa iniciadora es una proteína llamada Dronc, equivalente a las caspasas humanas 8 y 9. Dronc no solo pone en marcha la muerte celular, sino que también activa una vía de señalización llamada JNK, que refuerza el proceso y garantiza que la célula no dé marcha atrás.
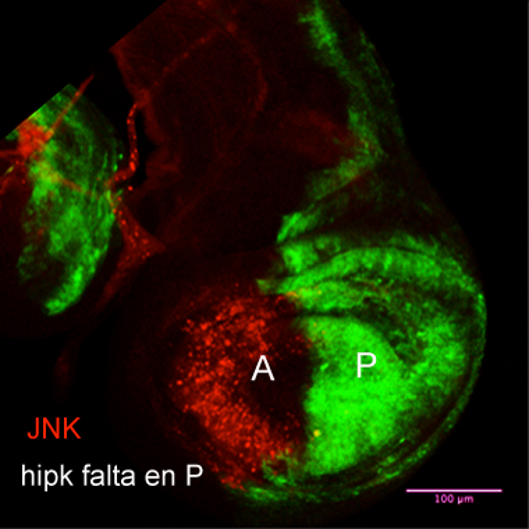
A pesar de su papel central, se sabía poco sobre cómo se regula la actividad de Dronc. Un estudio de los grupos de Ernesto Sánchez Herrero, Ginés Morata y Luis Alberto Baena-López en el Centro de Biología Molecular Severo Ochoa (CBM, CSIC-UAM) ha identificado ahora a una proteína clave en este control: Hipk, una quinasa que actúa como regulador molecular dentro de la célula.
“Sabíamos que Hipk estaba relacionada con la apoptosis, pero no cómo actuaba exactamente”, explica Sánchez-Herrero, investigador del CBM y autor del trabajo. “Nuestros resultados muestran que es esencial para que Dronc funcione correctamente”.
Para llegar a esta conclusión, los investigadores analizaron el desarrollo de tejidos de Drosophila que requieren una eliminación precisa de células, como el abdomen y la genitalia. Cuando Hipk no está presente, estas estructuras se forman de manera defectuosa, una señal clara de que la muerte celular no se ha producido como debería.
El equipo estudió también los discos imaginales, tejidos larvarios que darán lugar a las estructuras adultas de la mosca. Al activar o bloquear distintos genes implicados en la apoptosis y medir directamente la actividad de las caspasas, comprobaron que sin Hipk la proteína Dronc pierde eficacia.
Los datos indican que Hipk ayuda probablemente a estabilizar la forma activa de Dronc. En términos sencillos, Hipk permite que la señal de “muerte” sea lo suficientemente intensa y duradera. “Hipk actúa como un refuerzo del proceso, asegurando que la apoptosis llegue hasta el final”, resume Sánchez-Herrero.
Además, el estudio demuestra que Hipk es necesaria para que Dronc active la vía JNK, cerrando un circuito que amplifica la muerte celular cuando es necesaria. “Esto convierte a Hipk en un modulador central de la respuesta apoptótica, tanto durante el desarrollo como en situaciones de estrés”, señala Ginés Morata, también investigador del CBM.
Aunque el trabajo se ha realizado en moscas, sus implicaciones son amplias. La apoptosis está implicada en numerosas enfermedades humanas: cuando falla, las células pueden sobrevivir indebidamente, como ocurre en el cáncer; cuando se activa en exceso, puede contribuir a enfermedades neurodegenerativas. Estudios previos en vertebrados ya habían relacionado Hipk con la apoptosis, pero este es el primer trabajo que demuestra su papel directo en el control de la actividad de las caspasas iniciadoras.
“Entender cómo se regula la muerte celular es clave para comprender tanto el desarrollo normal como el origen de muchas enfermedades”, concluye Morata. “Este trabajo abre nuevas vías para investigar cómo modular estos procesos en el futuro”.
Referencia
The homeodomain-interacting protein kinase Hipk promotes apoptosis by stabilizing the active form of Dronc. García-Arias JM, Juárez-Uribe RA, Baena-López LA, Morata G, Sánchez-Herrero E. Cell Death Discov. 2025 Dec 16. doi: 10.1038/s41420-025-02916-9.