Programa Científico
Dinámica y función del genoma
GRUPO DE INVESTIGACIÓN
Telómeros en cáncer y regeneración

Ignacio Flores
El acortamiento de los telómeros durante la división celular puede causar fusiones teloméricas e inestabilidad genómica en tumores. Nuestro grupo investiga la formación y función de estas fusiones teloméricas utilizando técnicas bioquímicas, moleculares, CRISPR/Cas y análisis genómicos. El fin último de nuestra investigación es el descubrimiento de nuevos marcadores y tratamientos contra el cáncer
Investigación
Telómeros en cáncer y regeneración
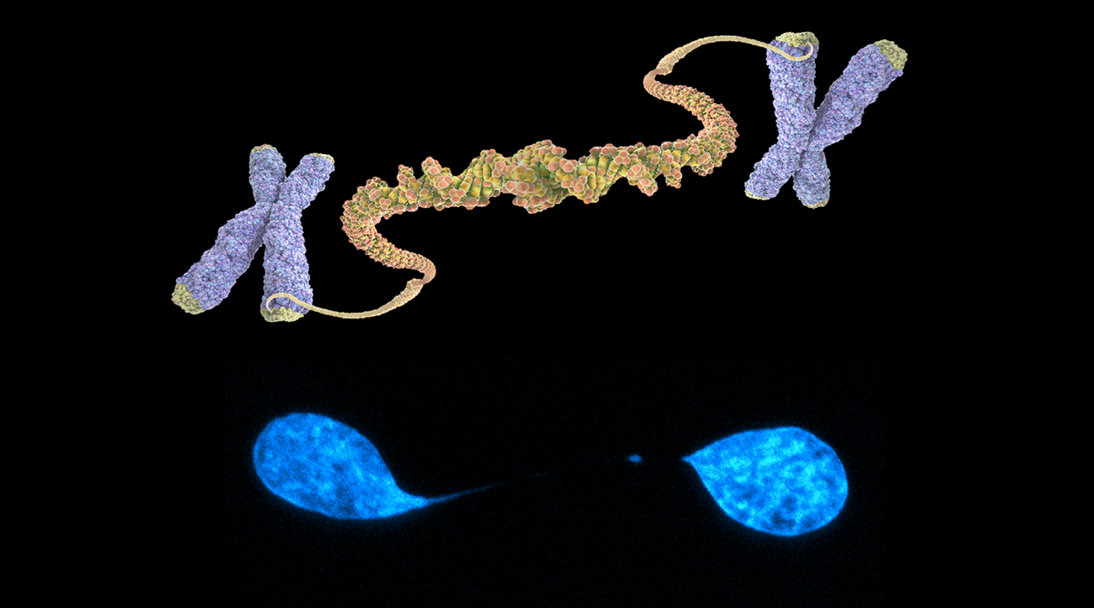
Telómeros en cáncer y regeneración. Los telómeros son componentes esenciales de nuestro genoma ya que lo protegen de su deterioro y mantienen su estabilidad. Las fusiones teloméricas ocurren cuando dos cromosomas se unen físicamente a través de sus extremos. Las fusiones teloméricas pueden desencadenar una serie de reordenamientos genómicos y alteraciones oncogénicas que, en última instancia, conducen al desarrollo de tumores malignos y a la resistencia a la quimioterapia. A pesar de su relevancia en la evolución tumoral, nuestra comprensión de los patrones y consecuencias de las fusiones teloméricas en el cáncer humano sigue siendo limitada. Nuestro grupo está interesado en comprender la función de las fusiones teloméricas en cáncer y regeneración.
Fusiones teloméricas (FT) en cáncer. En los últimos años hemos caracterizado las tasas y el espectro de las FT somáticas en más de 30 tipos de cáncer. Hemos descubierto que las FT están muy extendidas en los tumores humanos, con tasas que varían enormemente entre y dentro de los distintos tipos de cáncer. Además de FT de extremo a extremo, hemos identificado patrones únicos relacionados con la vía alternativa de alargamiento de los telómeros (ALT). Un descubrimiento especialmente interesante ha sido la detección de FT en la sangre de pacientes con cáncer, lo que ofrece un método potencial para la detección precoz del cáncer con alta especificidad y sensibilidad. Esto es especialmente prometedor para tipos de cáncer como el de páncreas y los tumores cerebrales, que actualmente cuentan con opciones limitadas para su detección precoz. Mediante técnicas bioquímicas, moleculares, CRISPR/Cas y genómicas (NGS), seguiremos investigando la aparición y la función de FT en diversos tumores humanos y de ratón. Comprender el papel de las FT será crucial para desarrollar terapias dirigidas en pacientes con cáncer.
Fusiones teloméricas (TF) en la maduración de los cardiomiocitos y en regeneración cardiaca. La maduración en muchas células de mamíferos, incluidos los cardiomiocitos, va acompañada de un aumento del número de cromosomas, o poliploidización. Dado que las células poliploides no logran dividirse en la mayoría de los casos, la aparición de la poliploidía puede explicar por qué los cardiomiocitos no proliferan lo suficiente para regenerar el corazón después de un infarto. A pesar de su importancia, el mecanismo de poliploidización en cardiomiocitos sigue sin estar bien definido. En los últimos años, utilizando imágenes de alto contenido, hemos descubierto que aproximadamente la mitad de los cardiomiocitos postnatales de ratón que entran en mitosis tienen puentes cromosómicos discernibles. Además, observamos que la ploidía de los cardiomiocitos coincide con un número creciente de FTs lo que sugiere una ruta directa a la poliploidización. FTs están presentes en los corazones de ratones, peces cebra, cerdos y humanos. Los corazones de pez cebra tienen relativamente pocas FTs, lo que correlaciona con que que sus cardiomiocitos son mayoritariamente diploides y su alta capacidad regenerativa. La eliminación de la telomerasa inhibe la respuesta regenerativa y aumenta el número de cardiomiocitos poliploides, lo que respalda la idea de que la poliploidización de los cardiomiocitos afecta a la regeneración del corazón. En conjunto, estos resultados identifican a las FT como un mecanismo que conduce a la formación de puentes cromosómicos y a la poliploidización, y sugieren que la citocinesis fallida de los cardiomiocitos se origina a partir de un defecto mitótico. Actualmente estamos investigando si una regulación precisa de la telomerasa evita la presencia de FTs, aumenta el número de cardiomiocitos diploides y amplía la ventana de regeneración cardiaca.
Miembros del grupo

Ignacio Flores Hernández
Lab.: 114.2 / 403 Ext.: 4581
iflores(at)cbm.csic.es

Ana María Andreea Badarau Radu
Lab.: 403 Ext.: 4608
andreea.b(at)cbm.csic.es

Irene Álvarez Mejías
Lab.: 403 Ext.: 4608
ialvarez(at)cbm.csic.es

María José Morillo Chincoa
Lab.: 403 Ext.: 4608
maria.morillo(at)cbm.csic.es
Publicaciones representativas
The ALT pathway generates telomere fusions that can be detected in the blood of cancer patients
Francesc Muyas et al.
Telomeres Fuse During Cardiomyocyte Maturation
Esther Aix, PhD et al.
Telomeres and telomerase in heart regeneration
Esther Aix et al.
Postnatal telomere dysfunction induces cardiomyocyte cell-cycle arrest through p21 activation
Esther Aix et al.