Programa Científico
Homeostasis de tejidos y órganos
UNIDADES EN ESTE PROGRAMA
Arquitectura celular y organogénesis Comunicación intercelular e inflamación
GRUPO DE INVESTIGACIÓN
Fisiopatología molecular de la inflamación y fibrosis peritoneal (PERINFIB)

Manuel López Cabrera
Los miofibroblastos y los fibroblastos asociados a cáncer (CAFs, por sus siglas en inglés) se consideran contribuyentes importantes a la respuesta fibroproliferativa peritoneal y a la preparación del nicho durante la metástasis peritoneal. Nuestro grupo ha demostrado que la mayoría de los miofibroblastos y CAFs peritoneales derivan de la célula mesotelial mediante una transición epitelio-mesenquimal (EMT, por sus siglas en inglés). En los últimos años, nos hemos dedicado a la búsqueda de herramientas pronósticas/diagnósticas y terapéuticas para mejorar los resultados de las enfermedades que afectan a la membrana peritoneal (fibrosis inducida por diálisis peritoneal (DP), adherencias postquirúrgicas y carcinomatosis peritoneal) mediante la identificación de mecanismos e intervenciones comunes que promuevan la preservación a largo plazo de la función de la membrana peritoneal y la supervivencia en afecciones peritoneales potencialmente mortales.
Investigación
La diálisis peritoneal (DP), utilizada para tratar la enfermedad renal crónica avanzada, consiste en emplear el peritoneo como membrana semipermeable a través de la cual se producen la difusión y la ultrafiltración. Durante la DP, el peritoneo se expone a soluciones bioincompatibles que provocan inflamación, angiogénesis y fibrosis, lo que resulta en fallo de la membrana. Nuestro grupo ha demostrado que las células mesoteliales experimentan una EMT en respuesta a la agresión peritoneal. En los últimos 16 años, se han publicado estudios que indican que la EMT mesotelial (también denominada transición mesotelio-mesenquimal, MMT) es un buen marcador del fallo de membrana y una diana terapéutica para prevenir la fibrosis y/o la angiogénesis inducidas por la DP.
Recientemente, nos planteamos si el proceso de MMT influye en otras patologías peritoneales, como la metástasis peritoneal y las adherencias postquirúrgicas. La metástasis peritoneal es una complicación de los carcinomas abdominales (p. ej., el carcinoma de ovario) para la que no existe un tratamiento eficaz. La progresión de los implantes metastásicos se ve afectada por los CAFs, que pueden derivar de diferentes tipos celulares. Hemos demostrado, en biopsias de implantes peritoneales humanos, que una subpoblación de CAFs deriva de células mesoteliales mediante MMT. Nuestros resultados también sugieren que la MMT aumenta la receptividad del peritoneo a la implantación de células tumorales, contribuye al crecimiento y la vascularización de tumores secundarios y que la MMT constituye una diana terapéutica en la carcinomatosis peritoneal.
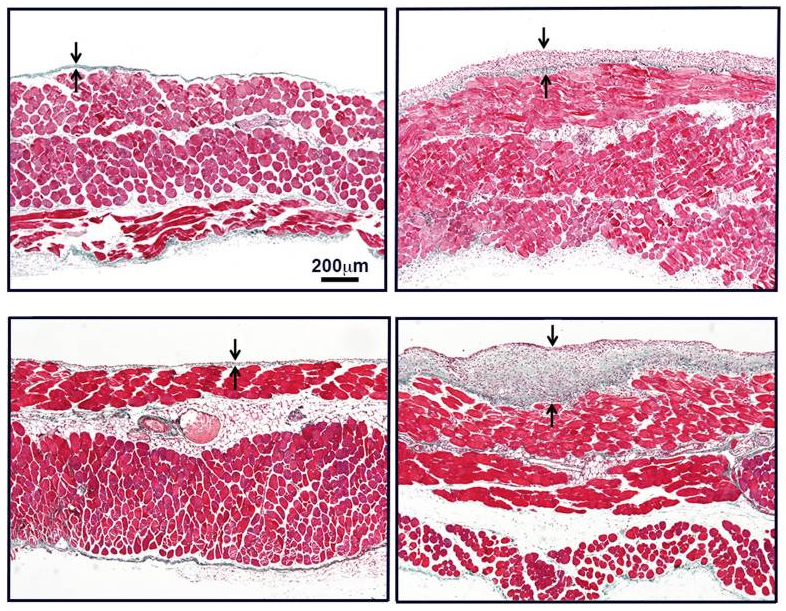
Las adherencias son áreas de tejido fibrótico que unen tejidos y órganos que normalmente no estarían conectados, y pueden ser potencialmente mortales. La mayoría de las adherencias son postquirúrgicas. Los análisis histológicos de adherencias postquirúrgicas humanas han demostrado que las células mesoteliales adyacentes al tejido fibrótico presentan signos de MMT, lo que sugiere que este podría ser un paso inicial en su desarrollo. Los procesos fisiopatológicos involucrados en su formación aún se desconocen. Resultados recientes han demostrado que la lesión mecánica es el principal inductor de la MMT durante la formación de adherencias. En consecuencia, las moléculas involucradas en la mecanotransducción, como la caveolina 1 (CAV-1), podrían desempeñar un papel en la modulación de la MMT mecánica y la formación de adherencias.
El objetivo de nuestro trabajo es ampliar el conocimiento de las implicaciones patológicas de la MMT de las células mesoteliales y de los mecanismos moleculares que regulan este proceso, e identificar dianas moleculares para el diseño de estrategias terapéuticas, con posibles aplicaciones en enfermedades asociadas a la fibrosis/angiogénesis peritoneal y en la metástasis peritoneal.
Miembros del grupo

Manuel López Cabrera
Lab.: 406 Ext.: 4604/4707
mlcabrera(at)cbm.csic.es

Mª Pilar Sandoval Correa
Lab.: 406 Ext.: 4707
psandoval(at)cbm.csic.es

Henar Tomero Sanz
Lab.: 406 Ext.: 4707
htomero(at)cbm.csic.es
Publicaciones representativas
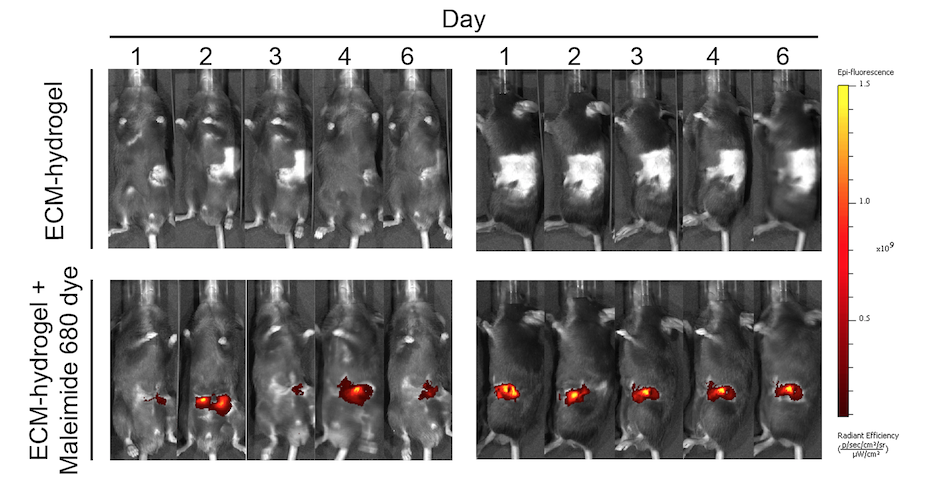
Sprayable extracellular matrix hydrogel reduces postoperative adhesion formation and protects healing tissues in preclinical models
Lucía Pascual-Antón, Pilar Sandoval et al. Science Translational Medicine, 2025.
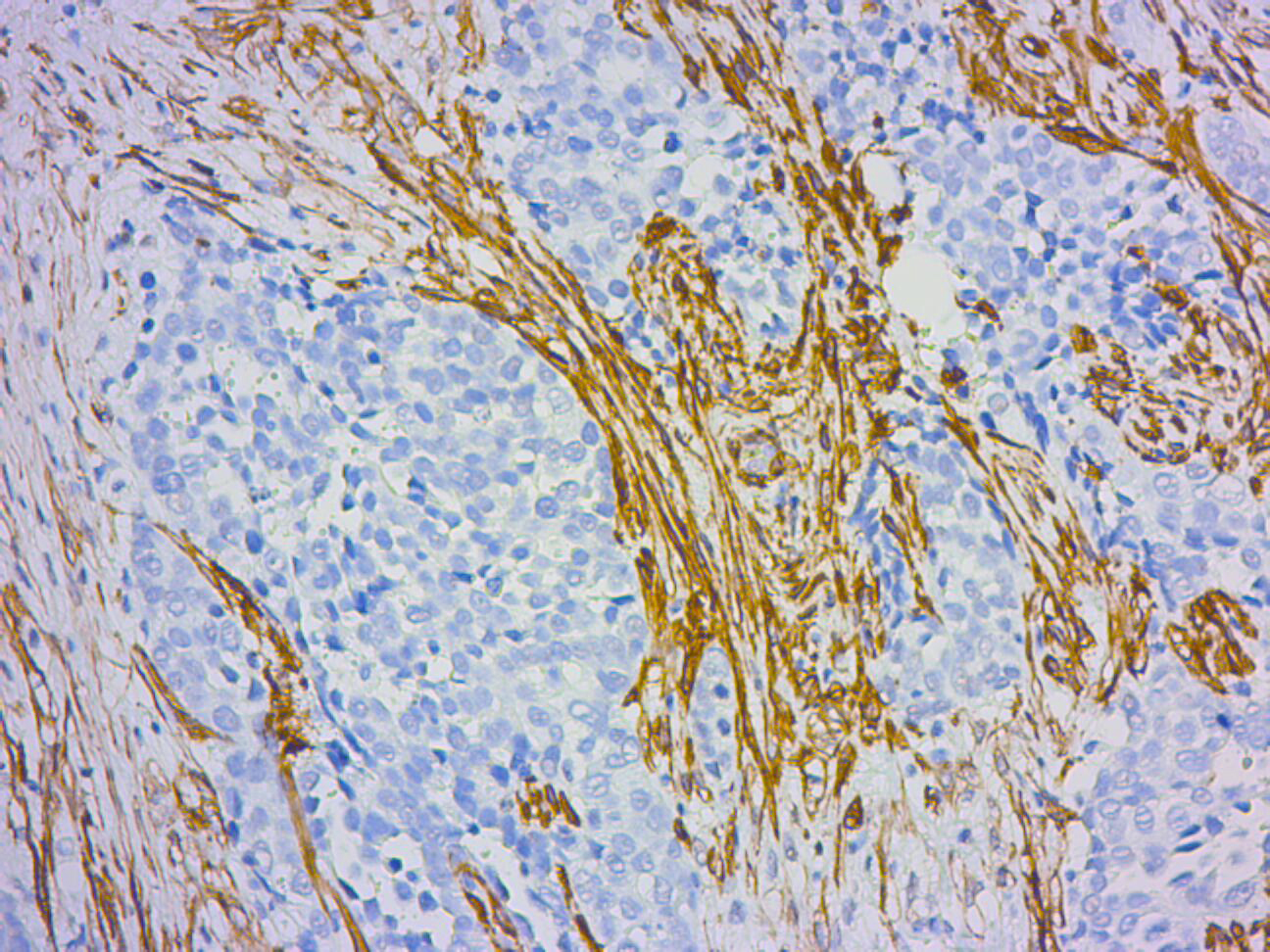
Targeting carcinoma-associated mesothelial cells with antibody-drug conjugates in ovarian carcinomatosis
Lucía Pascual-Antón, Pilar Sandoval et al. The Journal of Pathology, 2023.
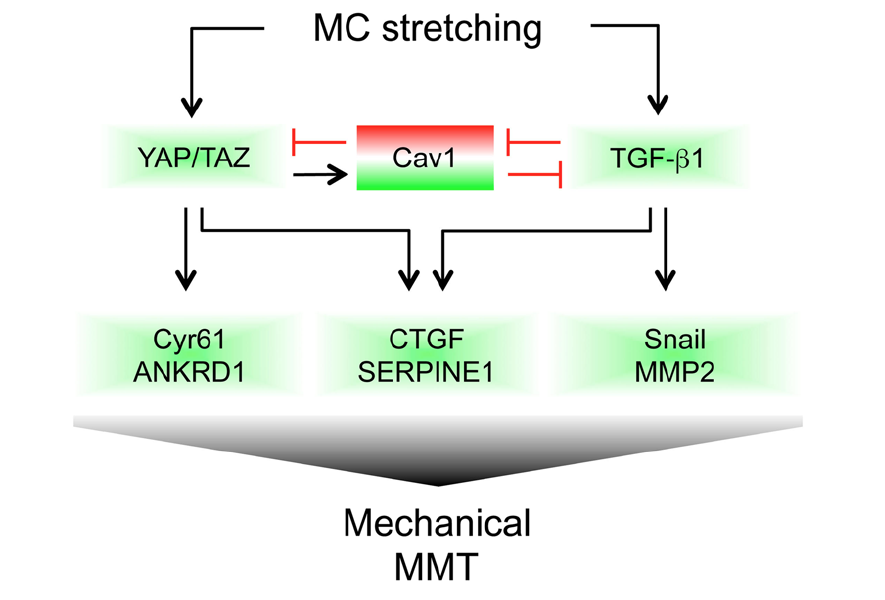
Caveolin1 and YAP drive mechanically induced mesothelial to mesenchymal transition and fibrosis
Raffaele Strippoli, Pilar Sandoval et al. Cell death & disease, 2020.
Immune-Regulatory Molecule CD69 Controls Peritoneal Fibrosis
Georgios Liappas et al. J Am Soc Nephrol, 2016. J Am Soc Nephrol, 2016.