Programa Científico
Homeostasis de tejidos y órganos
UNIDADES EN ESTE PROGRAMA
Arquitectura celular y organogénesis Comunicación intercelular e inflamación
GRUPO DE INVESTIGACIÓN
Investigación molecular y traslacional en patologías vasculares

Juan Miguel Redondo Moya
Nuestro laboratorio investiga los mecanismos moleculares implicados en enfermedades vasculares, incluidas las hereditarias como los síndromes de Marfan y Loeys-Dietz. Estudiamos vías de señalización y mediadores clave, y realizamos análisis proteómicos para identificar biomarcadores y dianas terapéuticas, con el fin de mejorar el diagnóstico, pronóstico y tratamiento de estas patologías.
Investigación
En los últimos años, nuestra investigación se ha centrado en los mecanismos moleculares y celulares que impulsan el remodelado vascular y la fisiopatología aórtica, especialmente en las enfermedades aórticas torácicas hereditarias (HTAD, por sus siglas en inglés).
Las enfermedades aórticas son responsables del 1%-2% de las muertes en países industrializados. El aneurisma aórtico (AA) provoca una dilatación progresiva y degeneración de la capa media, que con frecuencia culmina en una disección aguda (AD), con alta mortalidad. En HTAD como el síndrome de Marfan (MFS) y el síndrome de Loeys-Dietz (LDS), la dilatación aórtica aumenta el riesgo de AD, pero los tratamientos médicos y los predictores de riesgo siguen siendo muy limitados debido a lagunas en la comprensión de sus mecanismos moleculares. La cirugía es la única intervención eficaz, guiada por umbrales de diámetro, pero la AD puede ocurrir incluso en diámetros menores. Existe una necesidad urgente de (i) profundizar en el conocimiento mecanístico de las HTAD, (ii) identificar marcadores de riesgo fiables más allá del diámetro aórtico y (iii) desarrollar estrategias farmacológicas.
En colaboración con el grupo de Miguel Campanero, hemos identificado mediadores clave de la HTAD, como Adamts1, Nos2, C/EBPβ, Plk1 y Rcan1. La deficiencia de Adamts1 induce la enfermedad aórtica a través de la sobreproducción de NO mediada por NOS2, y los inhibidores de NOS2 previenen y revierten la patología en modelos de ratón MFS y Adamts1. También descubrimos que la vía NO-sGC-PKG está sobreactivada en el SMF debido a la acumulación de proteínas de la matriz extracelular, incluyendo Versican (Vcan) y Fibronectina (FN), que activan la vía AKT-NOS2. La deficiencia genética de Vcan, el silenciamiento lentiviral o la inhibición de AKT revirtieron la dilatación aórtica, poniendo de relieve nuevas dianas terapéuticas. Además, la acumulación de FN promueve la aortopatía del SMF a través de la señalización de integrinas, iniciando una cascada que hemos caracterizado en detalle. El mapeo de estas vías representa un gran avance, ya que establece la red de señalización más completa en la aortopatía del SMF hasta la fecha y vincula las alteraciones de la matriz extracelular con la señalización mediada por AKT-NO e integrinas. Nuestros datos también sugieren que la vía AKT-NOS2, anteriormente relacionada con el SMF, también desempeña un papel en el SDL, lo que justifica nuevas investigaciones.
Además, en colaboración con el grupo de Jesús Vázquez en el CNIC, hemos realizado análisis proteómicos que han identificado firmas moleculares dependientes e independientes del sexo en MFS y LDS, revelando patrones compartidos ausentes en controles y distintos grupos que diferencian estos síndromes. Este trabajo nos ha permitido identificar mediadores comunes, proteínas específicas de cada síndrome y marcadores asociados al sexo, que estamos caracterizando. También hemos identificado proteínas plasmáticas en pacientes con MFS que muestran una alta precisión diagnóstica y correlación con la gravedad clínica, lo que apoya su validación en curso como biomarcadores diagnósticos y pronósticos.
En conjunto, nuestra investigación busca proporcionar nuevas perspectivas sobre la fisiopatología de las HTAD y abrir vías para el descubrimiento de dianas terapéuticas y el desarrollo de biomarcadores en enfermedades aórticas.
Miembros del grupo

Juan Miguel Redondo Moya
Lab.: 311 Ext.: 4451
jmredondo(at)cbm.csic.es

María José Méndez Olivares
Lab.: 311 Ext.: 4447
mjmendez(at)cbm.csic.es

Sara Martínez Martínez
Lab.: 211 Ext.: 4401
smartinez(at)cbm.csic.es

Iván Alarcón Ruíz
Lab.: 311 Ext.: 4451
ivan.alarcon(at)cbm.csic.es
Publicaciones representativas
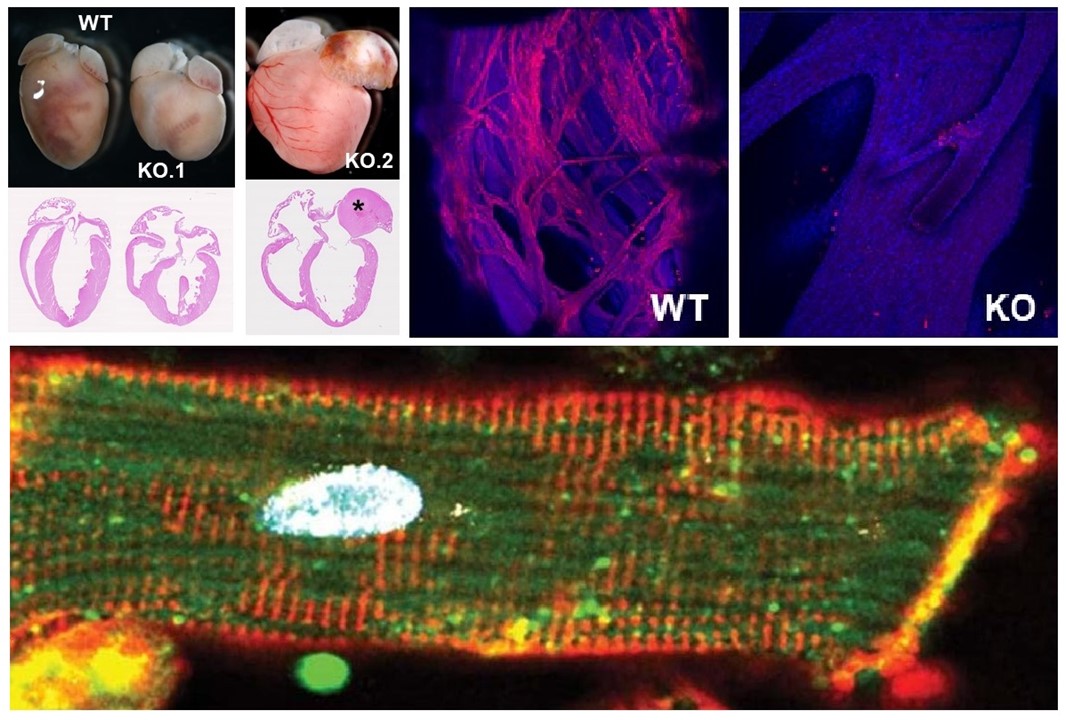
The G4 resolvase Dhx36 modulates cardiomyocyte differentiation and ventricular conduction system development
Gómez-Del Arco P et al.
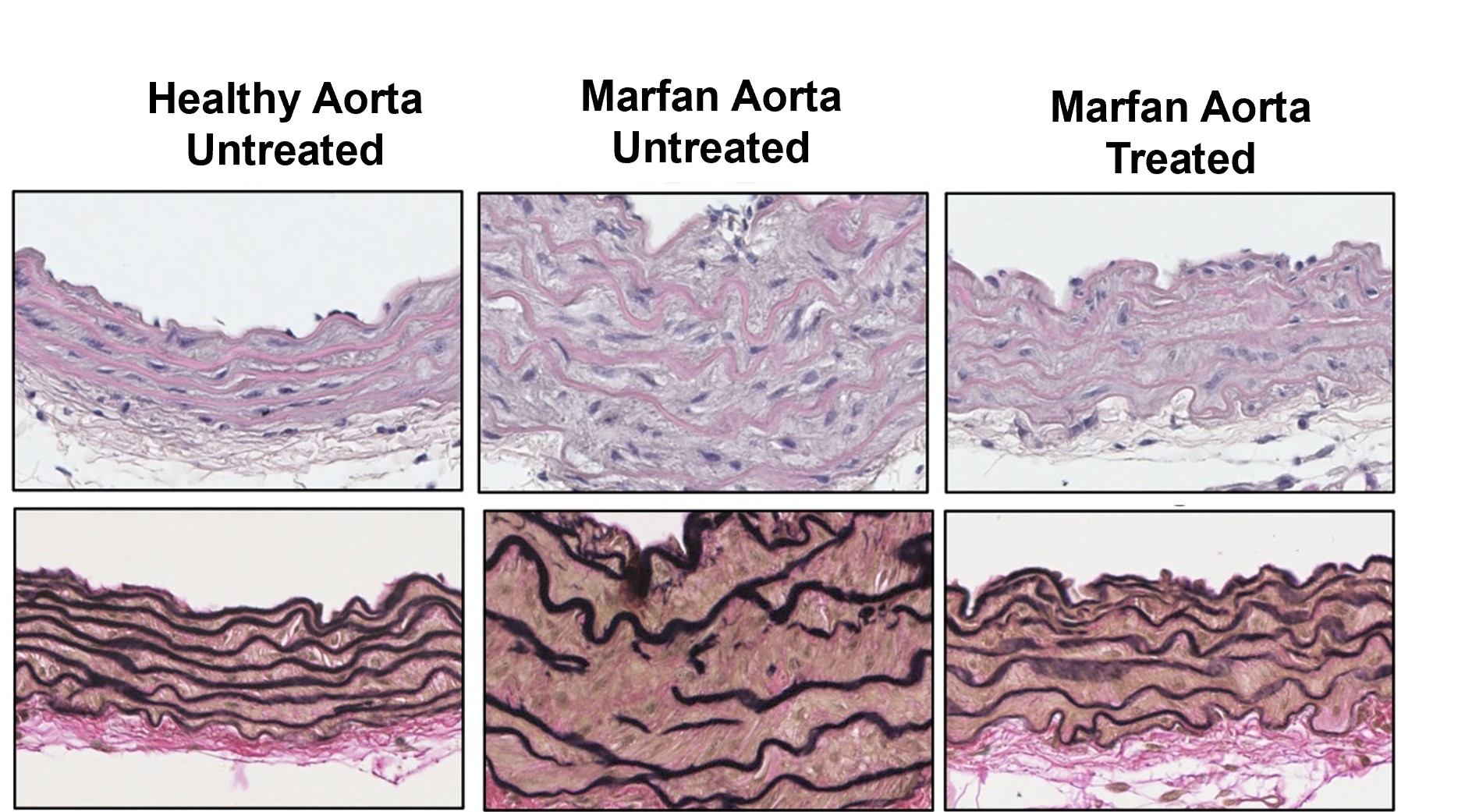
Aortic disease in Marfan syndrome is caused by overactivation of sGC-PRKG signaling by NO.
de la Fuente-Alonso A et al.
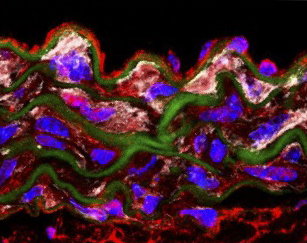
Nitric oxide mediates aortic disease in mice deficient in the metalloprotease Adamts1 and in a mouse model of Marfan syndrome.
Oller J et al.
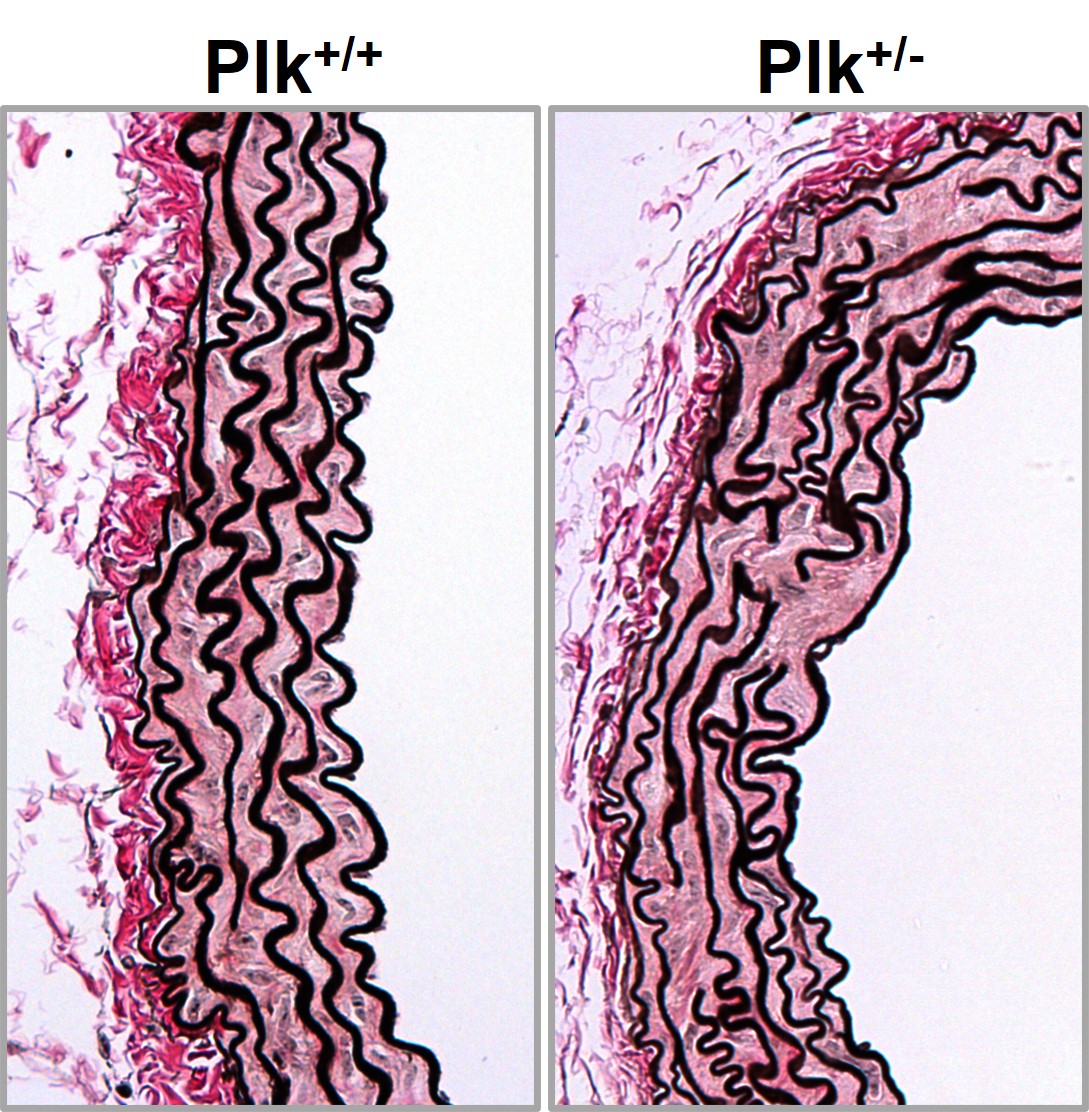
Plk1 regulates contraction of postmitotic smooth muscle cells and is required for vascular homeostasis.
de Cárcer G et al.