Programa Científico
Interacciones con el entorno
UNIDADES EN ESTE PROGRAMA
Los microbios en la salud y el bienestar Desarrollo y función del sistema inmunitario
GRUPO DE INVESTIGACIÓN
Autofagia no convencional y sus implicaciones en fisiología y patología

Felipe X. Pimentel-Muiños
En el laboratorio estudiamos cómo la maquinaria molecular que regula la autofagia también participa en otros procesos celulares aparentemente no relacionados con el proceso autofágico convencional que degrada componentes citoplasmáticos. Utilizamos técnicas de biología molecular y celular, así como modelos animales, para caracterizar estos procesos novedosos, evaluar hasta qué punto su disfución provoca enfermedad, y explorar su posible valor como dianas terapéuticas para diversas patologías.
Investigación
La autofagia es un proceso degradativo que elimina componentes celulares prescindibles o potencialmente dañinos y es crítico para el mantenimiento de la homeostasis celular. A juzgar por los fenotipos patológicos que se observan en ratones deficientes en las proteínas que constituyen la maquinaria autofágica (las llamadas proteínas ATG), la autofagia tiene un importante papel en la protección contra diversas enfermedades, incluyendo el cáncer, las enfermedades inflamatorias o algunos procesos neurodegenerativos. Esta capacidad protectora sugiere que la manipulación de la actividad autofágica podría tener valor terapéutico, una posibilidad que está siendo explorada con intensidad por diversos laboratorios en todo el mundo. Sin embargo, cada vez es más evidente que las diferentes ATGs tienen funciones alternativas no estrictamente relacionadas con la ruta autofágica canónica, bien porque su propósito no es degradativo, o bien porque las ATGs, aún mediando procesos catabólicos, funcionan de formas no convencionales que son fundamentalmente diferentes de la autofagia. La contribución de estas actividades no estrictamente autofágicas a la prevención de las patologías que surgen en ausencia de las ATGs es actualmente desconocida, pero constituye una cuestión de gran interés porque podría determinar la forma en que la función de las ATGs debe ser manipulada con un propósito terapéutico.
Con este objetivo general en mente, en nuestro laboratorio utilizamos la proteína ATG16L1 como paradigma para descubrir y estudiar nuevas actividades no convencionales de la maquinaria autofágica. En su función más canónica, ATG16L1 participa de forma crítica en la formación de los autofagosomas, vesículas citoplasmáticas de doble membrana que secuestran el material que va a ser degradado en el lisosoma a través de la ruta autofágica convencional. Pero ATG16L1 presenta un dominio C-terminal que es irrelevante para esta actividad canónica y parece tener funciones no convencionales en una amplia variedad de procesos celulares. Los proyectos que actualmente se desarrollan en nuestro grupo pretenden identificar y caracterizar con detalle nuevas funciones no canónicas de ATG16L1 y otros miembros de la maquinaria autofágica, y explorar su relación con la ruta convencional. Actividades de interés que estamos estudiando incluyen:
Regulation of endocytosis, intracellular trafficking and signaling output of cytokine receptors
Control of the stability of signaling mediators and the regulation of inflammatory responses
Regulation of immunogenic cell death and its impact in cancer and response to chemotherapy
Innate immunity against intracellular bacterial infections
To characterize these processes we use a wide variety of experimental systems include in vitro (cell lines) as well as in vivo (animal models) genetically engineered using the CRISPR/Cas9 system, proteomics techniques and bioinformatics approaches to identify novel mediators. We are currently trying to characterize in depth these mechanisms, discover novel non-canonical activators of ATG16L1 and explore how all these activities may be influenced by a coding polymorphic allele of ATG16L1 (T300A) whose presence in homozygosis increases the risk of suffering different pathologies, including Crohn’s disease, a serious intestinal inflammatory disease that is currently incurable. In this particular context, we intend to explore the molecular bases of complex, multifactorial diseases caused by the T300A allele, like Crohn’s disease. Exploring and establishing ways to manipulate atypical autophagy with therapeutic intentions is also a central long-term goal of our group that we intend to develop over the next few years.
Miembros del grupo

Tamara Rosell García
Lab.: 411 Ext.: 4737
trosell(at)cbm.csic.es

Felipe X. Pimentel Muiños
Lab.: 411 Ext.: 4737
fxp(at)cbm.csic.es

Daniel Antonio Oña Sánchez
Lab.: 411 Ext.: 4738
donia(at)cbm.csic.es

Julia Bandera Linero
Lab.: 411 Ext.: 4738
julia.bandera(at)cbm.csic.es

Santiago Tomás Díaz Neto
Lab.: 411 Ext.: 4738
santiagodiazneto(at)cbm.csic.es

Rocío Díaz Parra
Lab.: 411 Ext.: 4738
rocio.diaz(at)cbm.csic.es
Publicaciones representativas
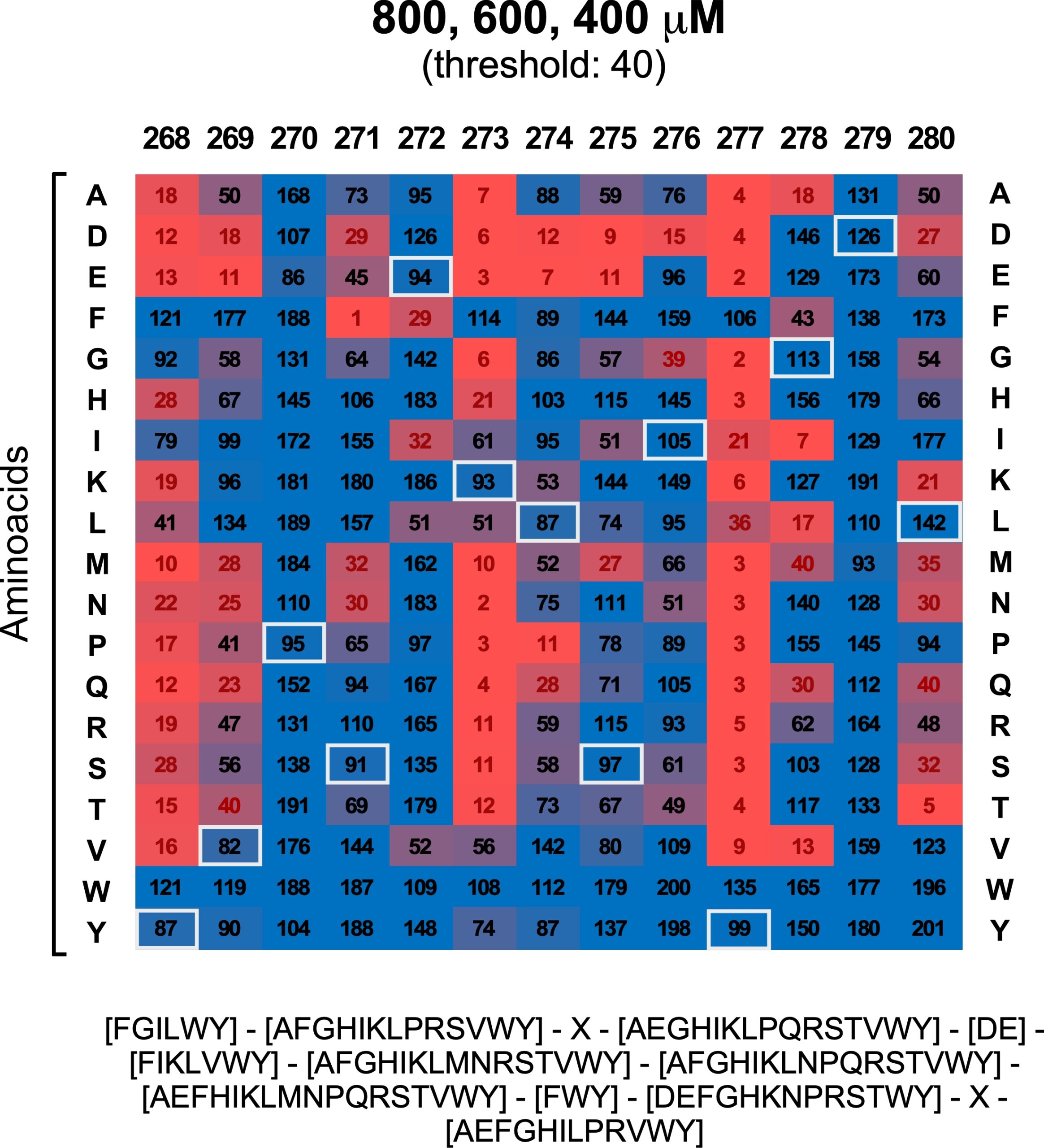
Regulation of cytokine signaling through direct interaction between cytokine receptors and the ATG16L1 WD40 domain
Inmaculada Serramito-Gómez et al.
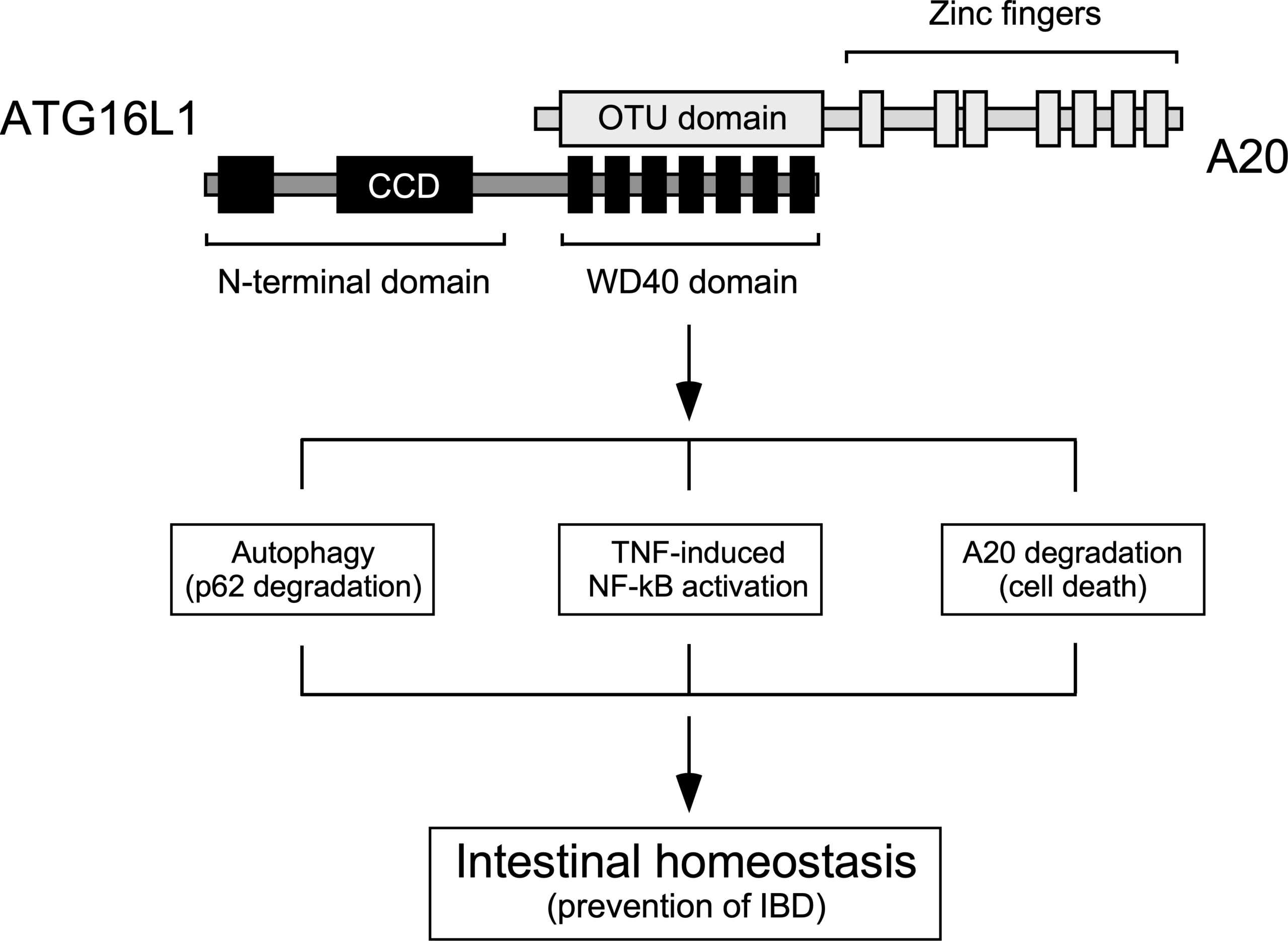
Physical and functional interaction between A20 and ATG16L1-WD40 domain in the control of intestinal homeostasis
Karolina Slowicka et al.
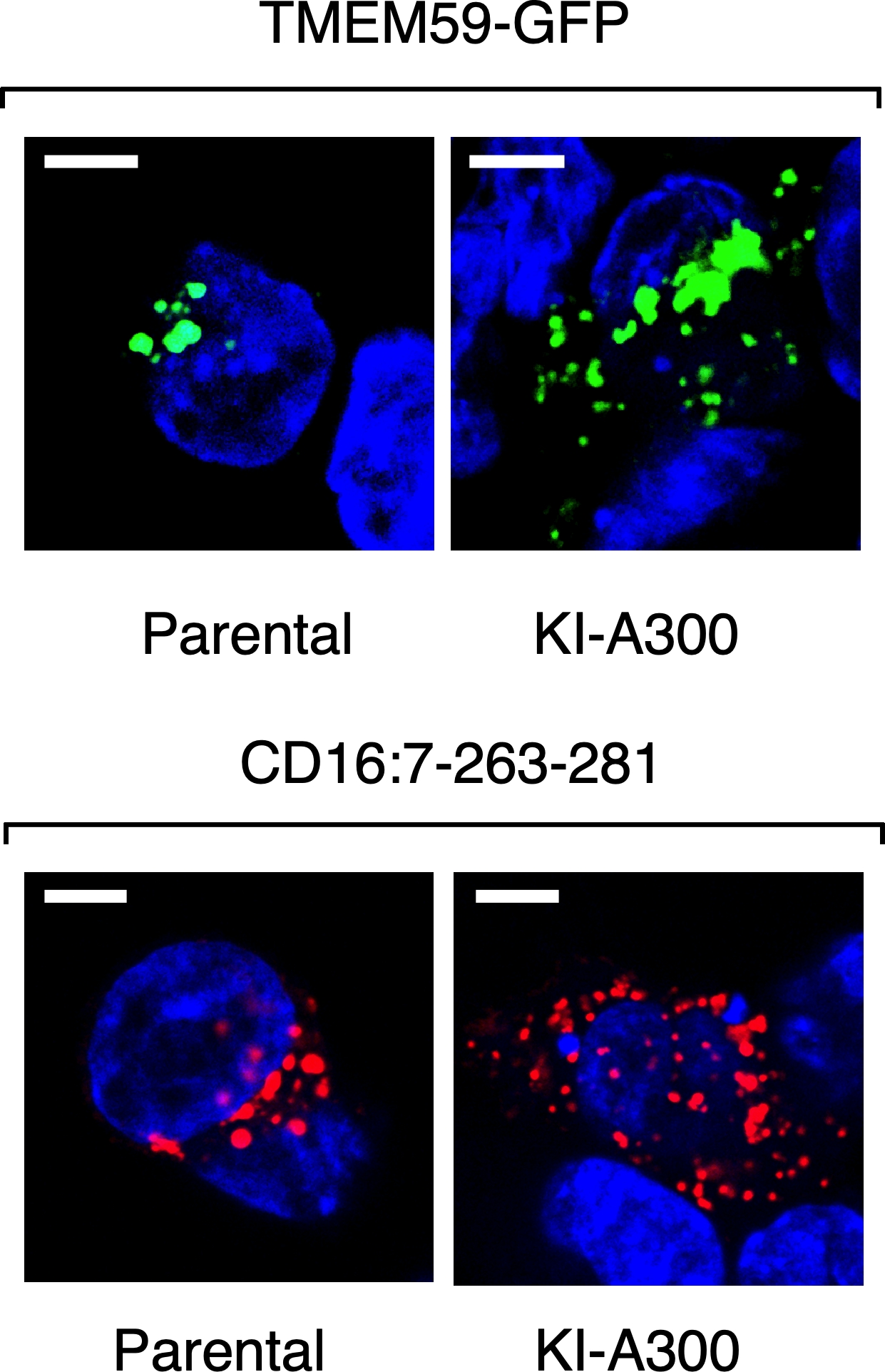
The T300A Crohn’s disease risk polymorphism impairs function of the WD40 domain of ATG16L1
Emilio Boada-Romero et al.
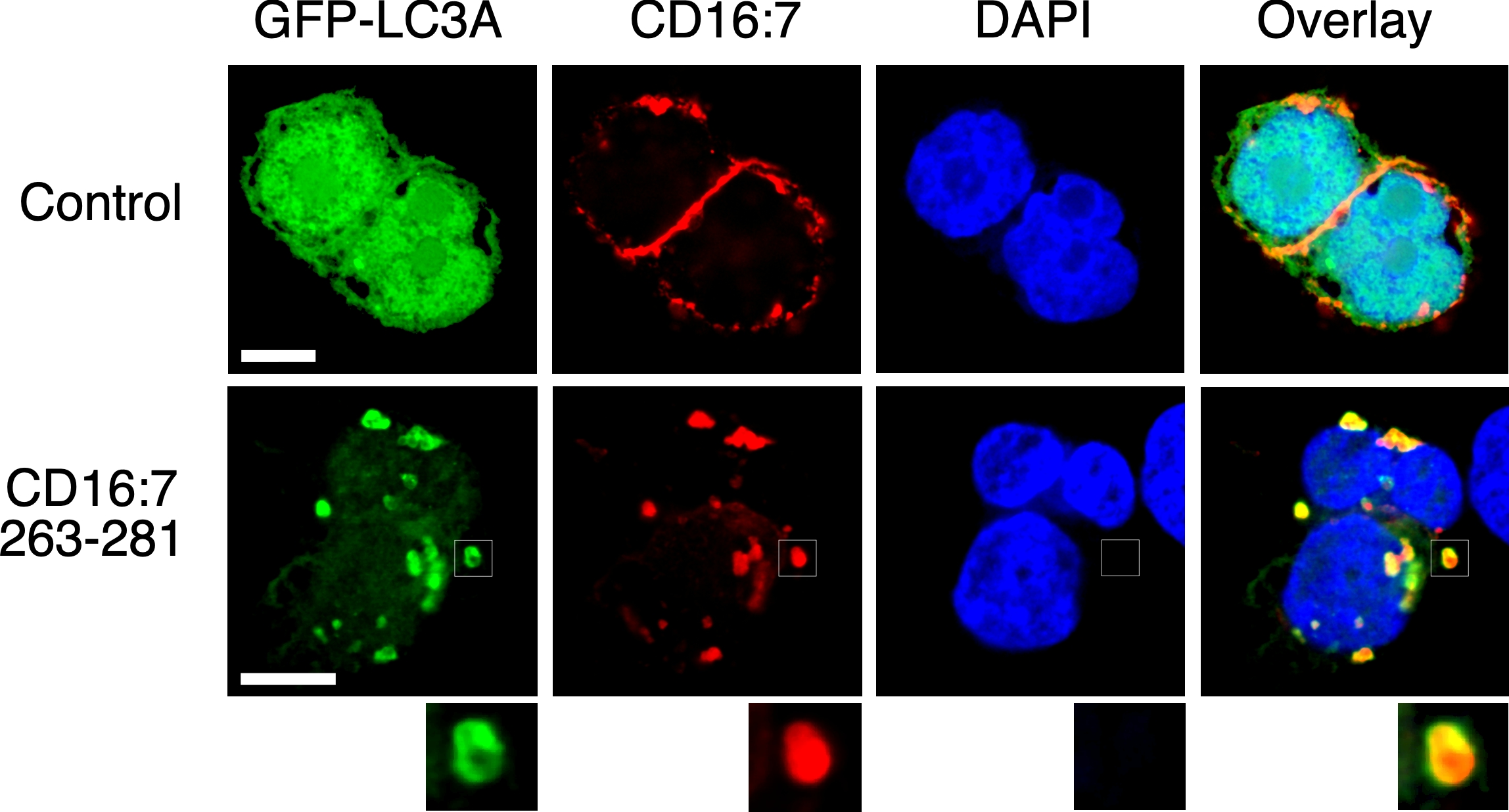
TMEM59 defines a novel ATG16L1-binding motif that promotes local activation of LC3
Emilio Boada-Romero et al.