Programa Científico
Interacciones con el entorno
UNIDADES EN ESTE PROGRAMA
Los microbios en la salud y el bienestar Desarrollo y función del sistema inmunitario
GRUPO DE INVESTIGACIÓN
Plasticidad celular en desarrollo y cáncer

César Cobaleda Hernández
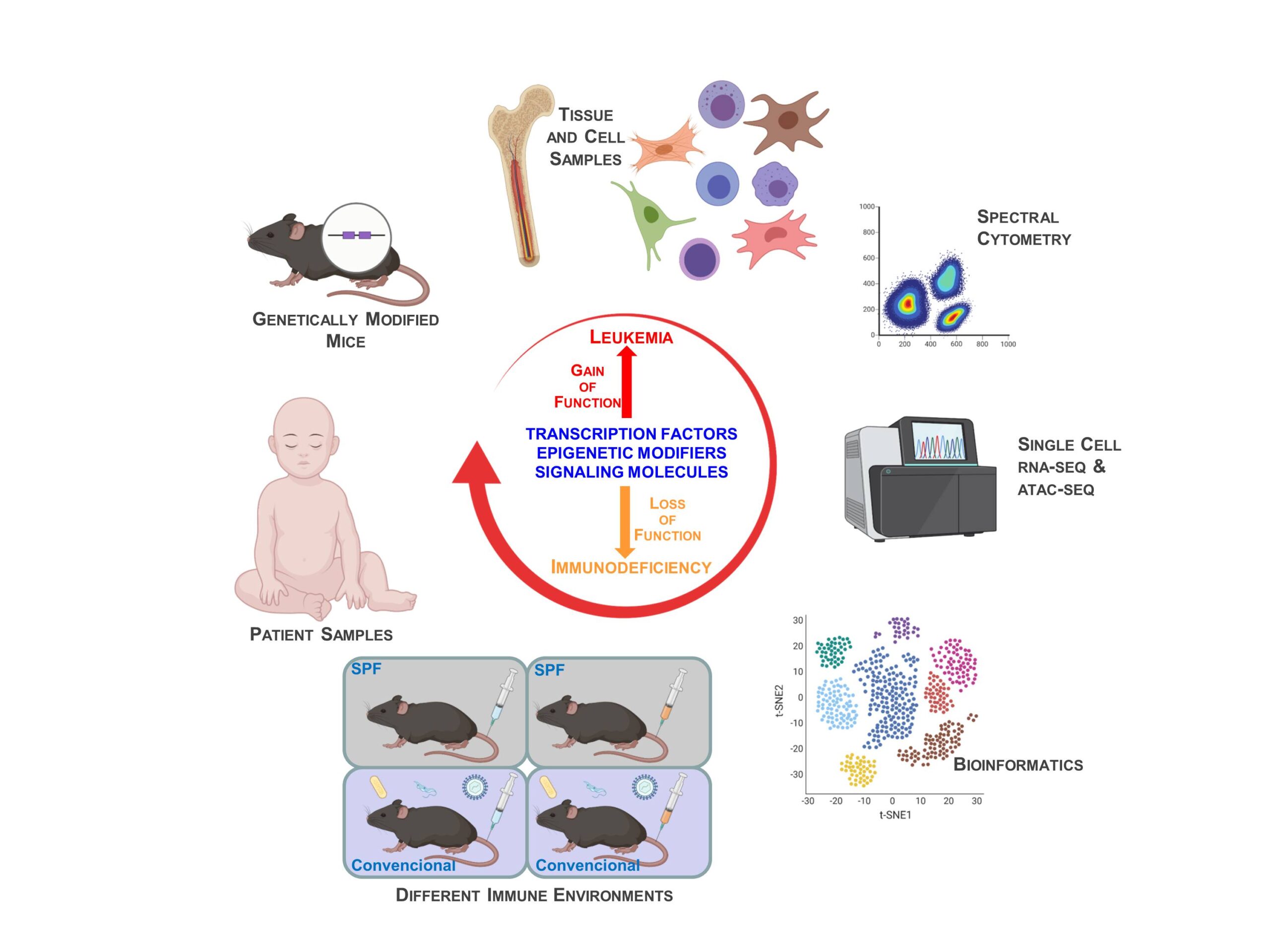
¿Cómo se determina la identidad de las células sanguíneas? Cuando su identidad se altera, las células pueden volverse tumorales (leucemia) o disfuncionales (inmunodeficiencias); por eso, entender la plasticidad celular es esencial para la terapia. En nuestro grupo estudiamos las patologías hematopoyéticas usando muestras de pacientes y ratones modificados que reproducen las enfermedades humanas.
Investigación
La plasticidad celular, dicho de manera sencilla, es la capacidad de las células de cambiar su identidad y convertirse en un tipo celular diferente. Implica la capacidad de adoptar el perfil de expresión génica de otros tipos de células y de adquirir sus funciones, y es una característica esencial de las células madre. A nivel intracelular, la plasticidad está principalmente controlada por factores de transcripción y reguladores epigenéticos que permiten a las células cambiar su identidad activando o silenciando distintos programas de desarrollo. Cualquier alteración de esta regulación conduce a cambios patológicos de la plasticidad celular, caracterizados por la aparición de identidades celulares aberrantes, como ocurre en el caso del cáncer o en los síndromes genéticos del desarrollo.
En nuestro grupo queremos entender cómo se determina la identidad celular durante el desarrollo de los linfocitos, y cómo se desregula en condiciones patológicas como las leucemias y las inmunodeficiencias. Como herramientas experimentales utilizamos: i) muestras de pacientes y ii) modelos de ratones modificados genéticamente en los que alteramos la expresión de factores de transcripción y reguladores epigenéticos, ya sea normales u oncogénicos.
PLASTICIDAD CELULAR EN LEUCEMIAS
La leucemia linfoblástica aguda de células B (B-ALL) es la forma más común de cáncer infantil. Curiosamente, casi el 5% de todos los recién nacidos sanos presentan algún tipo de predisposición genética innata para desarrollar B-ALL. Afortunadamente, muy pocos (<1%) de estos niños predispuestos desarrollarán B-ALL, tras sufrir una segunda mutación que lleve al desarrollo de la enfermedad. Las causas que desencadenan esta progresión aún no están claras, pero la incidencia de B-ALL parece estar aumentando paralelamente a la adopción de estilos de vida modernos. Se ha postulado que un estrés en el sistema inmunológico está involucrado en la progresión a B-ALL, y que este estrés podría ser desencadenado por la exposición a infecciones comunes (bajo ciertas circunstancias), o por otros factores estresantes como los antibióticos, la dieta o alteraciones en la microbiota. Entender la interacción entre el estrés inmunológico y las células preleucémicas existentes en tantos (5%) recién nacidos podría proporcionarnos estrategias dirigidas a prevenir la B-ALL infantil.
En nuestro grupo hemos generado ratones que expresan las lesiones oncogénicas responsables del inicio de las B-ALL infantiles, y hemos demostrado que las infecciones comunes son de hecho uno de los principales factores desencadenantes que conducen al desarrollo de la leucemia. Además, hemos demostrado que el tratamiento farmacológico preventivo con inhibidores de vías de señalización oncogénicas protege a los ratones predispuestos frente a la aparición de la enfermedad, mostrando que, efectivamente, la B-ALL podría ser una enfermedad prevenible. Dado que la presencia de células premalignas latentes es una característica común de muchos tipos de cánceres, nuestros resultados ofrecen una prueba de principio general para el desarrollo de estrategias preventivas similares para otros tipos de tumores.
PLASTICIDAD CELULAR EN INMUNODEFICIENCIAS
El síndrome de Wolf Hirschhorn (WHS) es una enfermedad rara (poco frecuente) y compleja causada por la pérdida de material genético en el brazo «p» del cromosoma 4. Los pacientes afectados presentan numerosas complicaciones graves, incluidas inmunodeficiencias que ponen en peligro la vida de los pacientes al causar una mayor susceptibilidad a las infecciones. Uno de los genes afectados en el WHS es WHS-Candidate-1 (WHSC1), un regulador epigenético involucrado en muchos procesos que afectan la función del genoma y que, curiosamente, también está mutado en B-ALL infantiles y otros tumores de células B como el mieloma múltiple (por eso WHSC1 también se conoce como Multiple Myeloma SET domain protein, MMSET). Hemos generado distintos modelos de ratones modificados genéticamente en los que alteramos de distintas formas la función de Whsc1, con el fin de comprender la biología molecular de las patologías hematopoyéticas asociadas con este gen. Esto nos está permitiendo entender mejor el papel de la epigenética en el desarrollo hematopoyético normal y aberrante, y proponer futuras intervenciones terapéuticas para estas patologías. Así, hemos demostrado que la pérdida de Whsc1 es esencial para la diferenciación y función normales de las células B, vinculando experimentalmente dicha pérdida con la inmunodeficiencia de los pacientes de WHS, y generando así un modelo preclínico para el desarrollo de terapias.
PLASTICIDAD CELULAR EN MIELOMA MÚLTIPLE
También hemos colaborado en la generación de nuevos modelos de ratones de mieloma múltiple mediado por MMSET, que recapitulan las características de la enfermedad humana y muestran una correlación entre las características genéticas e inmunológicas de cada tumor y su respuesta a terapias preclínicas, lo que permite la predicción de los resultados del tratamiento con inmunoterapias de próxima generación.
Miembros del grupo

César Cobaleda Hernández
Lab.: 325 Ext.: 4692
cesar.cobaleda(at)csic.es

Jorge Martínez Cano
Lab.: 325 Ext.: 4691
jorge.martinez(at)cbm.csic.es

Rodrigo Bailey Maldonado
Lab.: 325 Ext.: 4469
rbailey(at)cbm.csic.es

Laura Moreno de Lara
Lab.: 325 Ext.: 4691
lmoreno(at)cbm.csic.es

Raquel Cantalejo Gómez
Lab.: 325 Ext.: 4692
Publicaciones representativas
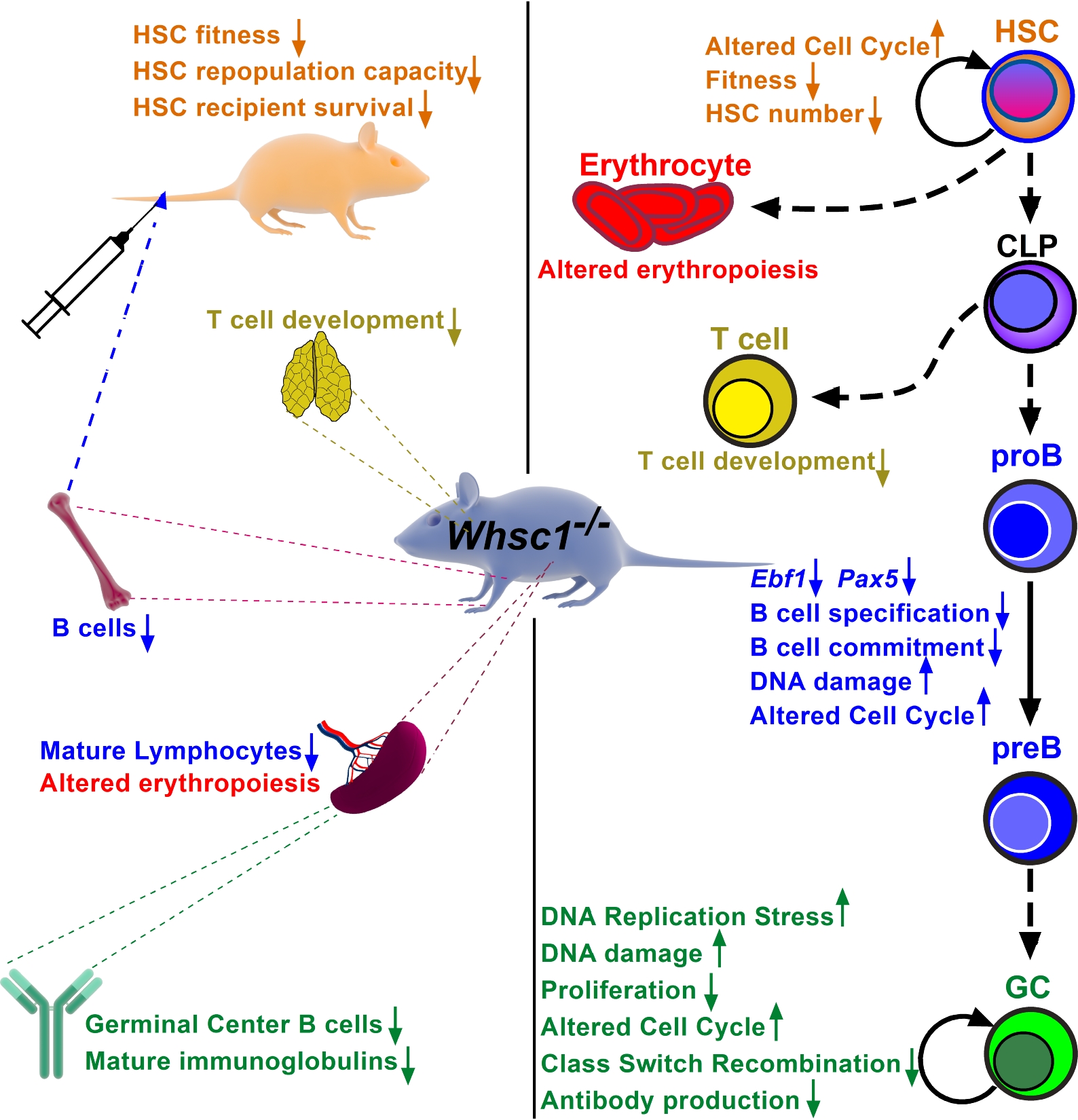
Wolf-Hirschhorn Syndrome Candidate 1 Is Necessary for Correct Hematopoietic and B Cell Development
Elena Campos-Sanchez et al.
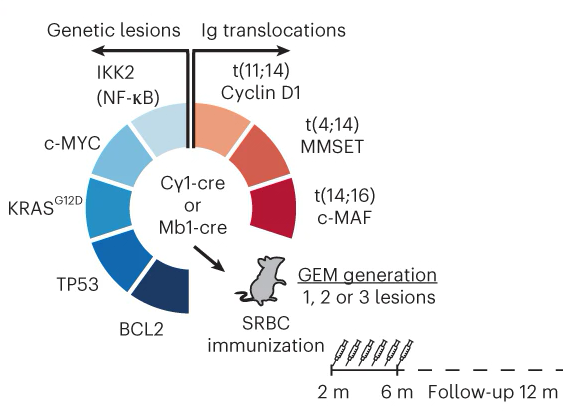
Preclinical models for prediction of immunotherapy outcomes and immune evasion mechanisms in genetically heterogeneous multiple myeloma
Marta Larrayoz et al.
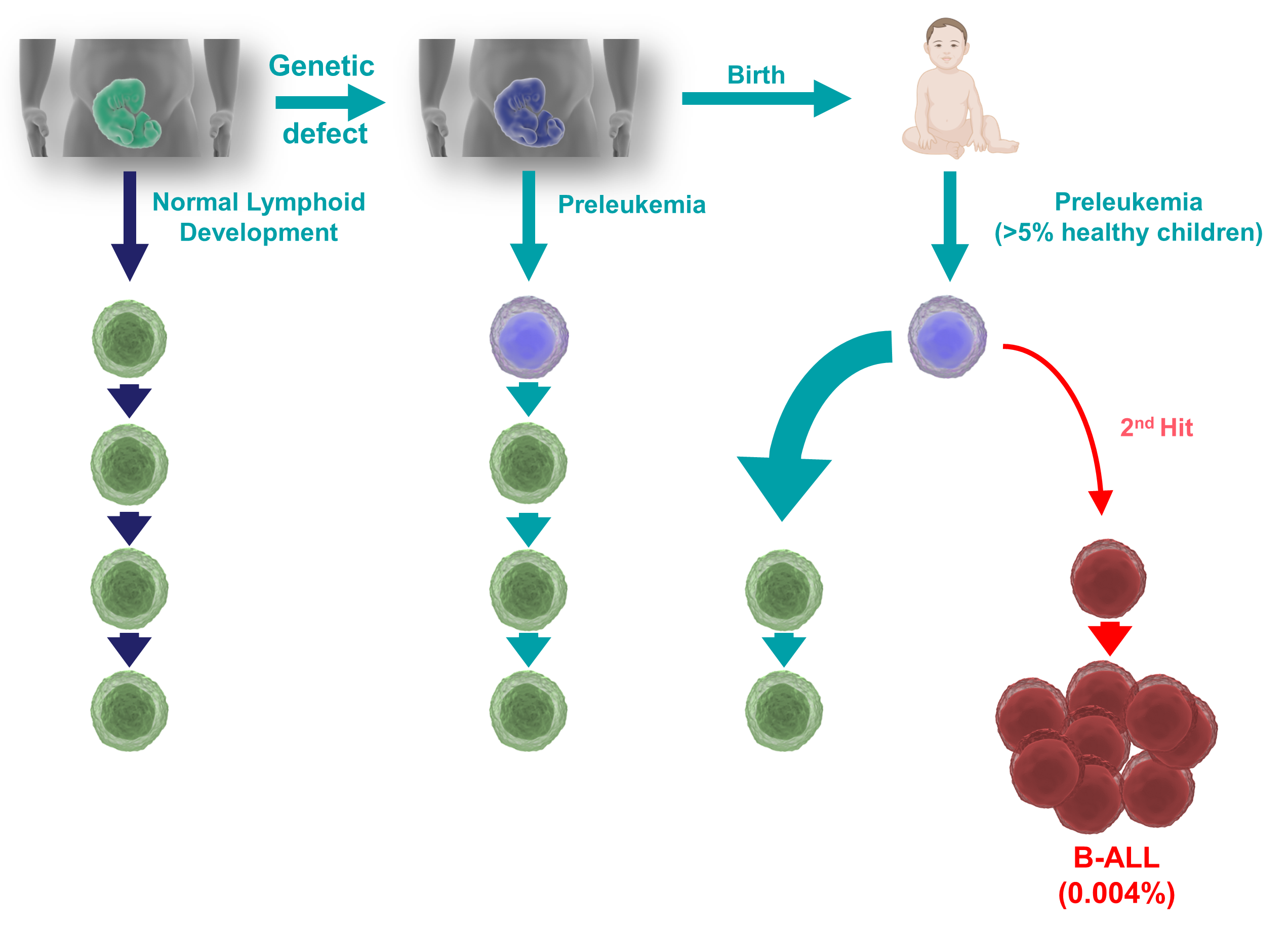
Infectious triggers and novel therapeutic opportunities in childhood B cell leukaemia
Cesar Cobaleda et al.
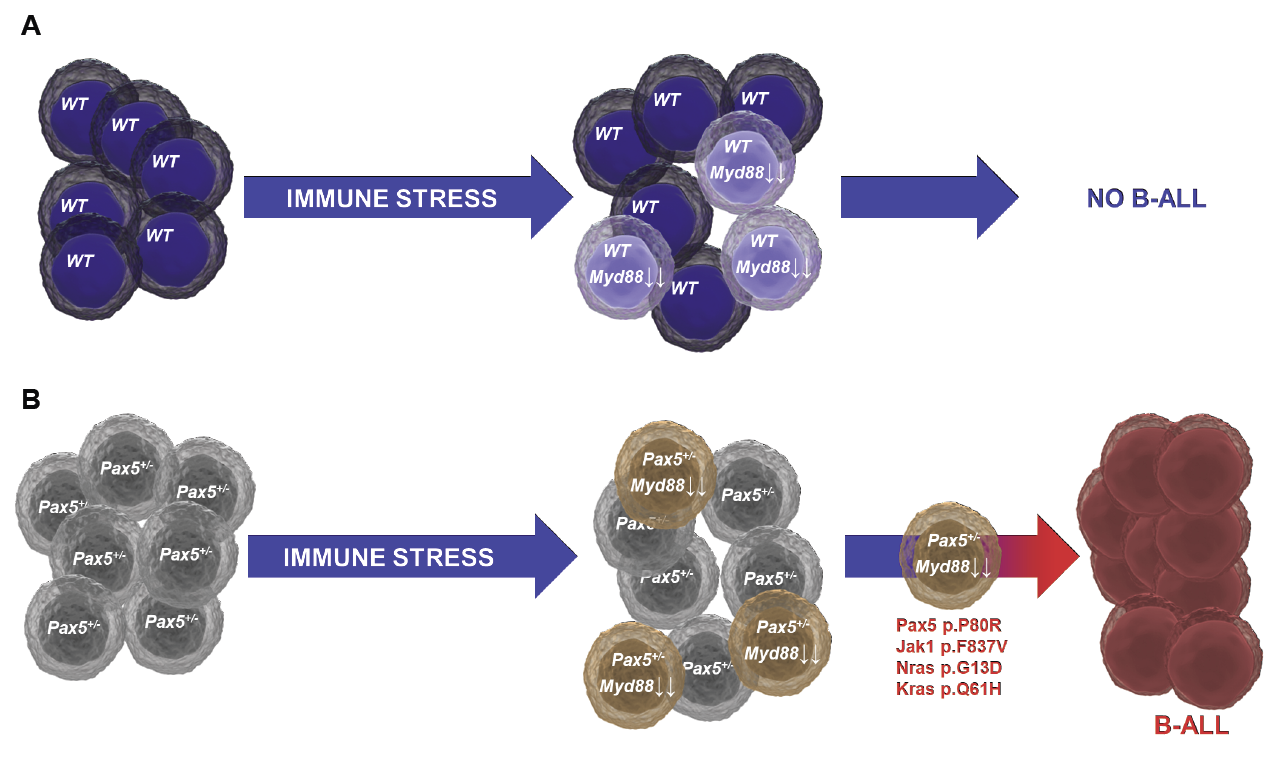
Immune stress suppresses innate immune signaling in preleukemic precursor B-cells to provoke leukemia in predisposed mice
Marta Isidro-Hernández et al.