Programa Científico
Interacciones con el entorno
UNIDADES EN ESTE PROGRAMA
Microorganismos en la salud y el bienestar Desarrollo y función del sistema inmunitario
GRUPO DE INVESTIGACIÓN
Retrotranscriptasa del virus de la inmunodeficiencia humana y terapia antirretroviral

Luis Menéndez Arias
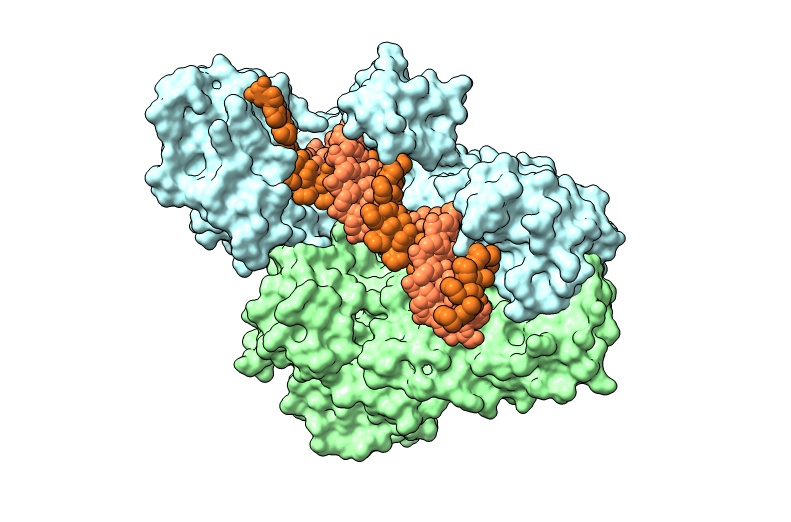
Nuestra investigación actual en la replicación del virus de la inmunodeficiencia humana (VIH) se centra en el descubrimiento de nuevos fármacos antivirales que actúen sobre dianas no explotadas en las terapias actuales (por ej., la ribonucleasa H), así como en la comprensión de las relaciones estructura-función de la retrotranscriptasa viral para mejorar su potencial biotecnológico.
Investigación
Nuestra investigación actual en la replicación del virus de la inmunodeficiencia humana (VIH) se centra en el descubrimiento de nuevos fármacos antivirales que actúen sobre dianas no explotadas en las terapias actuales (por ej., la ribonucleasa H (RNasa H)), así como en la comprensión de las relaciones estructura-función de la retrotranscriptasa viral para mejorar su potencial biotecnológico.
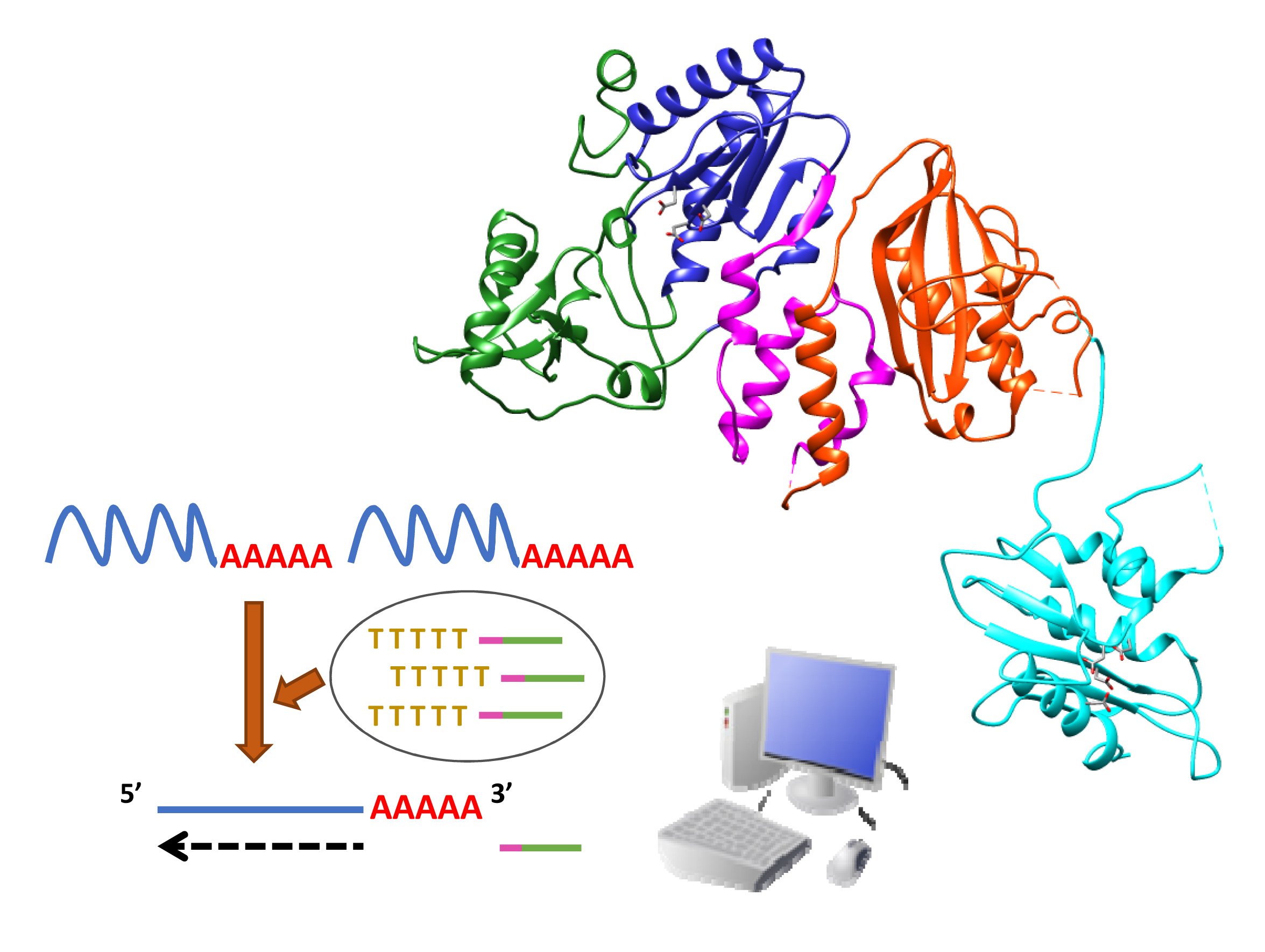
En colaboración con investigadores chinos, hemos descrito recientemente nuevos derivados de ácido gálico y de cumarina como potentes inhibidores de la actividad RNasa H del VIH-1 (valores de IC50 alrededor de 65 nM y 4 μM, respectivamente). Los derivados de cumarina seleccionados se caracterizaron como inhibidores duales de las actividades de la ADN polimerasa y la RNasa H del VIH-1, y mostraron eficacia antiviral en cultivos celulares (EC50 ~ 5,6 μM). Recientemente demostramos que la inactivación mutacional de la RNasa H de la RT elimina su eficiencia de transferencia de hebra al tiempo que disminuye la actividad de desplazamiento de la hebra dependiente de ARN. Curiosamente, la actividad residual puede eliminarse por completo mediante la adición de derivados de cumarina y esta propiedad podría utilizarse en biotecnología, en reacciones de RNA-seq para obtener coberturas de lectura más uniformes al copiar ARN largos, especialmente cuando se utilizan varios cebadores.
Nuestros proyectos actuales incluyen la búsqueda de nuevos candidatos a inhibidores de la RNasa H contra cepas diversas del VIH-1 y el VIH-2, y su posible extensión a otras dianas virales (como por ejemplo, el virus de la hepatitis B y los herpesvirus), basándose en la conservación del pleagamiento estructural de la RNasa H en otras enzimas víricas, como por ejemplo, la integrasa del VIH-1 o diversas exonucleasas. También pretendemos diseñar nuevas RTs con mayor afinidad por los complejos ARN/ADN con el fin de mejorar su eficiencia en la síntesis de ADN copia, particularmente en presencia de cantidades minúsculas de ARN. Utilizaremos el diseño racional para obtener enzimas modificadas con mayor afinidad de unión a ácidos nucleicos y, además, planeamos obtener proteínas de fusión que contengan dominios que podrían mejorar la eficiencia catalítica de la RT (por ejemplo, proteínas constituyentes de nucleocápsidas víricas, topoisomerasas o helicasas). Por otro lado, planteamos desarrollar métodos para evaluar la fidelidad de la síntesis de ADN de una manera efectiva y económica y estudiar los determinantes moleculares que controlan esta actividad.
Miembros del grupo

Luis Menéndez Arias
Lab.: 124 Ext.: 4494
lmenendez(at)cbm.csic.es

Sabina Andreu Satue
Lab.: 124 Ext.: 4523
sandreu(at)cbm.csic.es

María de la Vega Craqui Cordero
Lab.: 124 Ext.: 4494

Maialen Crespo Rodríguez
Lab.: 124 Ext.: 4494
Publicaciones representativas
Reverse Transcriptase: From Transcriptomics to Genome Editing
Samara Martín-Alonso et al.
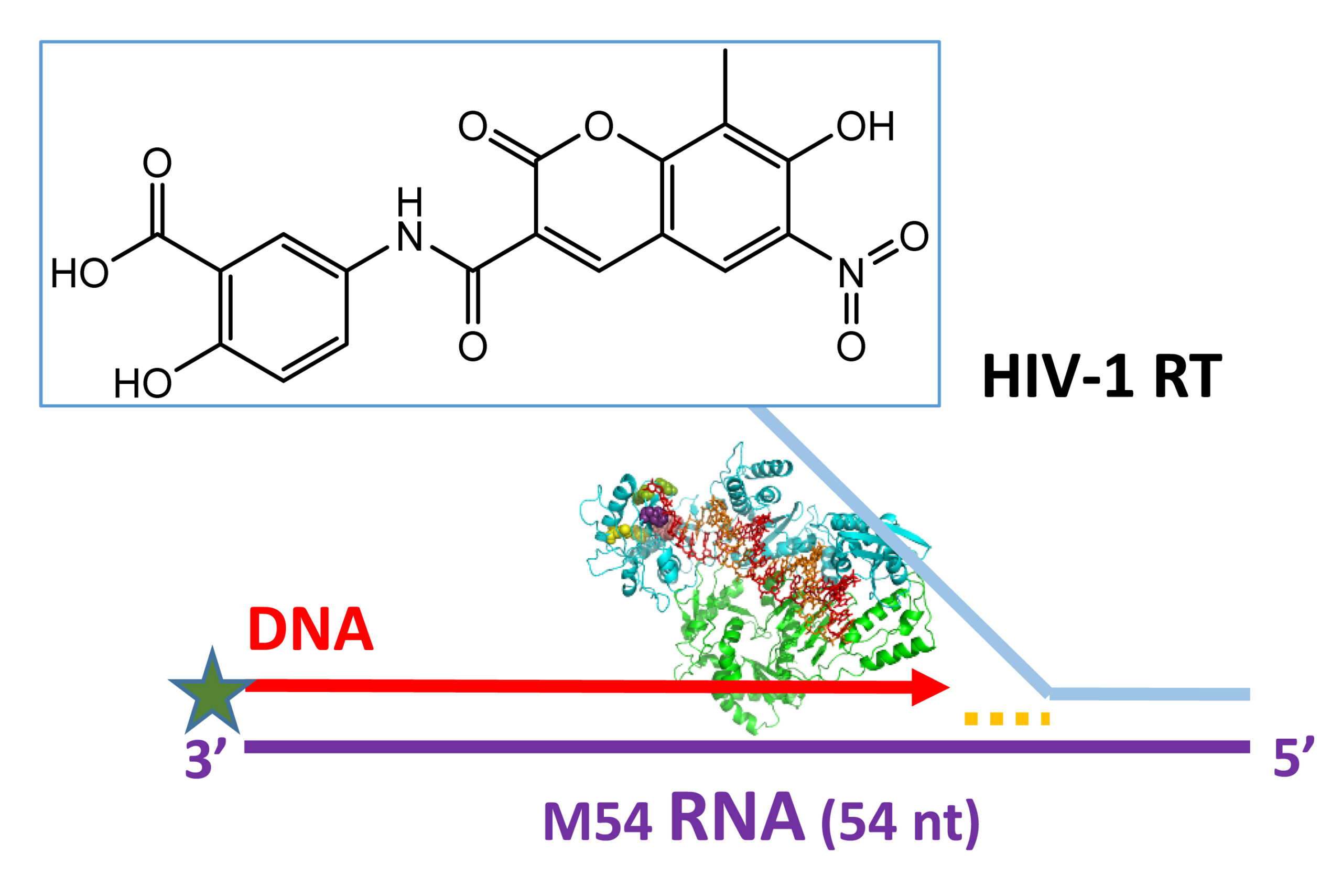
Novel RNase H Inhibitors Blocking RNA-directed Strand Displacement DNA Synthesis by HIV-1 Reverse Transcriptase
Samara Martín-Alonso et al.
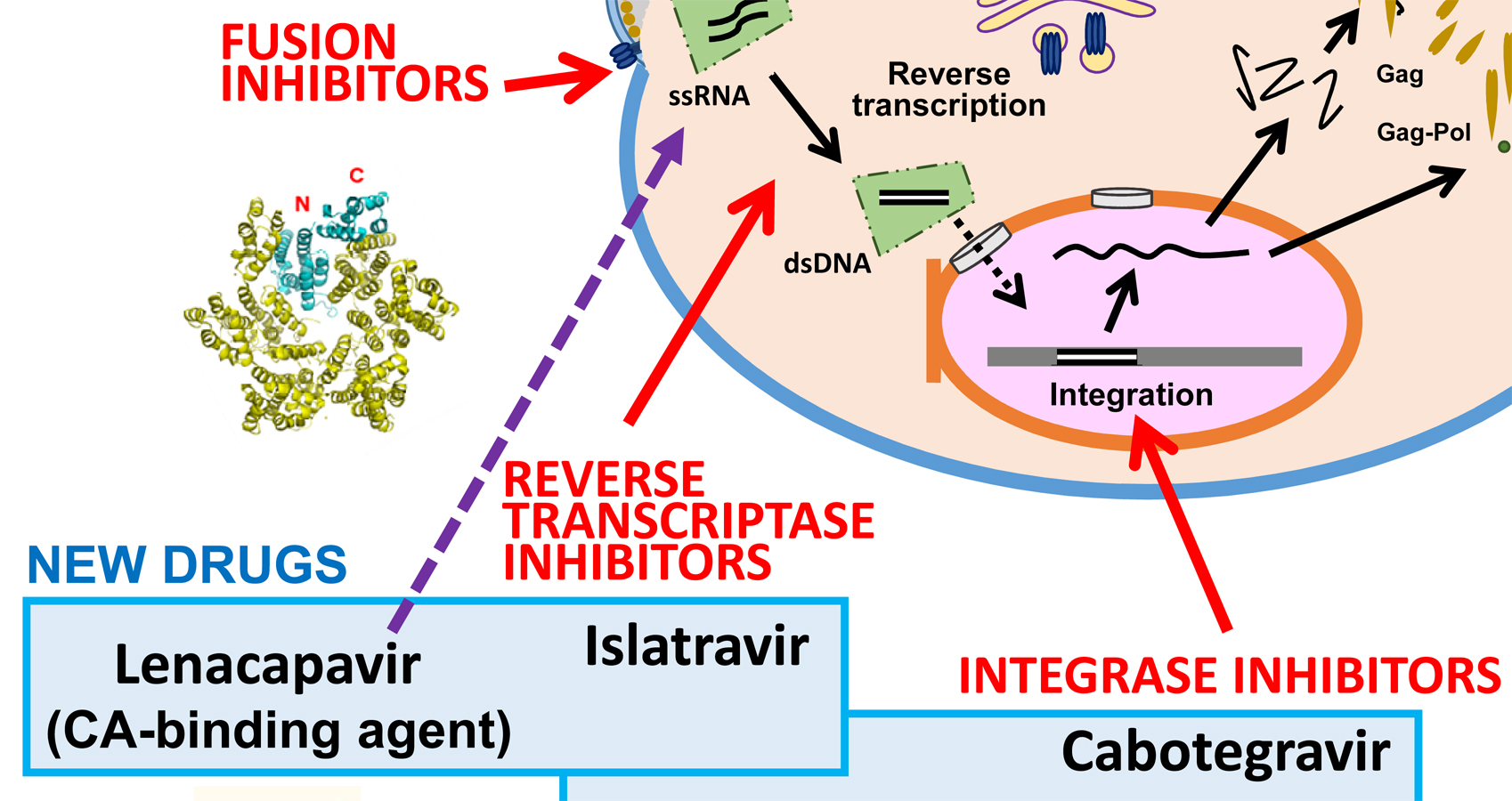
Update and latest advances in antiretroviral therapy
Luis Menéndez-Arias et al.
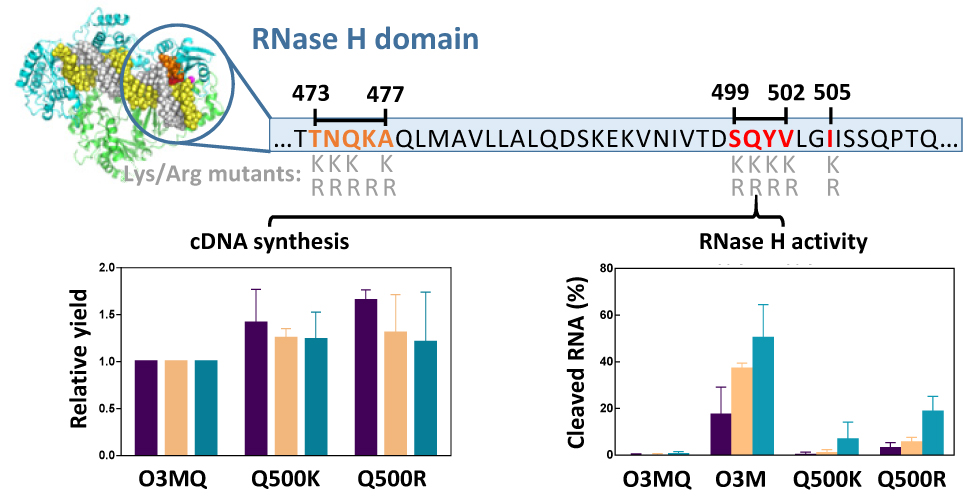
Charge Engineering of the Nucleic Acid Binding Cleft of a Thermostable HIV-1 Reverse Transcriptase Reveals Key Interactions and a Novel Mechanism of RNase H Inactivation
Javier Martínez Del Río et al.