Programa Científico
Procesos fisiológicos y patológicos
UNIDADES EN ESTE PROGRAMA
Neuropatología molecular Redes metabólicas y señalizadoras en la enfermedad
GRUPO DE INVESTIGACIÓN
Enfermedad de Huntington y otras enfermedades del sistema nervioso central

Jose J. Lucas
Estudiamos las bases moleculares de las enfermedades cerebrales con el fin de desarrollar curas. Gran parte de nuestro trabajo estudia la enfermedad de Huntington como enfermedad paradigmática con una causa conocida (una mutación), lo que nos permite generar ratones transgénicos en los que estudiar el curso de la enfermedad. Esto ha revelado procesos moleculares también alterados en muchas otras enfermedades cerebrales, como errores en el procesamiento del ARN (splicing y poliadenilación).
Investigación
Estudiamos los mecanismos moleculares subyacentes a las enfermedades cerebrales generando modelos genéticos de ratón, como los modelos HD94 y Tet/GSK3 de Huntington y Alzheimer, o el modelo TgCPEB4Δ4 (Nature 560:441-446, 2018; Nature 637:496-503, 2025) de autismo idiopático, para validar vías patogénicas y probar nuevas estrategias terapéuticas.
La enfermedad de Huntington (EH) es una enfermedad neurodegenerativa autosómica dominante caracterizada por movimientos involuntarios, síntomas psiquiátricos y demencia. Está causada por una expansión del trinucleótido CAG localizado en el gen de la huntingtina. Al caracterizar las interacciones moleculares del ARN y la proteína mutados, y en particular su impacto sobre las proteínas de unión al ARN y el procesamiento del ARN, encontramos nuevas pistas sobre la EH y otros trastornos neuronales como el parkinsonismo distónico ligado al cromosoma X (XDP), la epilepsia, el autismo, la esquizofrenia y la esclerosis múltiple.
For instance, by characterizing the global mis-splicing signature in HD striatum (Brain 143: 2207-19, 2020 & Brain 144:2009-23, 2021) we found an alteration of tau (the protein that accumulate inside neurons in Alzheimer’s disease). By analyzing transgenic HD mouse models with varying levels of tau we demonstrated that tau contributes to HD pathogenesis and we discovered a new histopathological hallmark, the Tau Nuclear Rods or Tau Nuclear Indentations (Nat Med 20:881-5, 2014).
Characterizing the role of cytoplasmic polyadenylation of mRNAs by CPEBs in HD, we discovered a treatable thiamine deficiency in HD brains (Sci Transl Med 2021 13:eabe7104) which has originated a clinical trial (https://clinicaltrials.gov/ct2/show/NCT04478734).
We also found that the majority of autism spectrum disorder (ASD) risk genes are targets of CPEB4. In fact, CPEB4 shows an isoform imbalance in individuals with autism due to mis-splicing of a neuronal specific microexon. Accordingly, mice with equivalent CPEB4 imbalance show autism-like phenotype (Nature 560:441-446, 2018; Nature 637:496-503, 2025) and have become a useful model of idiopathic autism.
We have also described alterations of cytoplasmic polyadenylation system in epilepsy (Brain 143: 2139-53 2020) and schizophrenia (Biol Psychiatry 94:341-351, 2023).
Miembros del grupo

José Javier Lucas Lozano
Lab.: 209 Ext.: 4552
jjlucas(at)cbm.csic.es

Miriam Lucas Santamaría
Lab.: 209 Ext.: 4582
mmlucas(at)cbm.csic.es

Julia Pose Utrilla
Lab.: 209 Ext.: 4582
jpose(at)cbm.csic.es

Claudia Ortega Salgado
Lab.: 209 Ext.: 4582

Alejandra María Arroyo García
Lab.: 209 Ext.: 4582
amarroyo(at)cbm.csic.es

Sandra García Pereira
Lab.: 209 Ext.: 4582
sagap(at)cbm.csic.es

Carlos Costas Insua
Lab.: 209 Ext.: 4552
carlos.costas(at)cbm.csic.es

Fabio Desideri
Lab.: 209 Ext.: 4582
fabio.desideri(at)cbm.csic.es
Publicaciones representativas
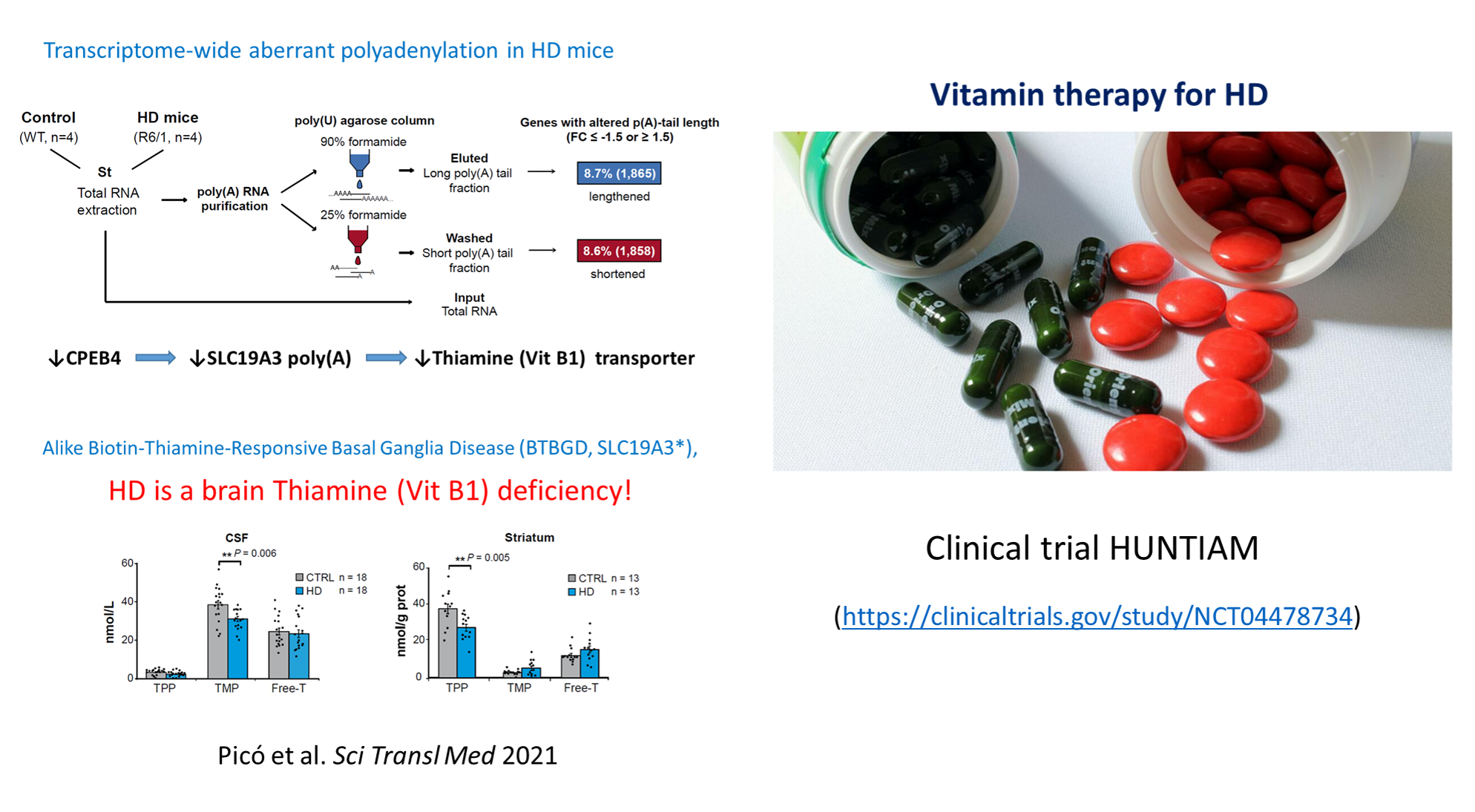
CPEB alteration and aberrant transcriptome-polyadenylation lead to a treatable SLC19A3 deficiency in Huntington’s disease
Sara Picó et al.
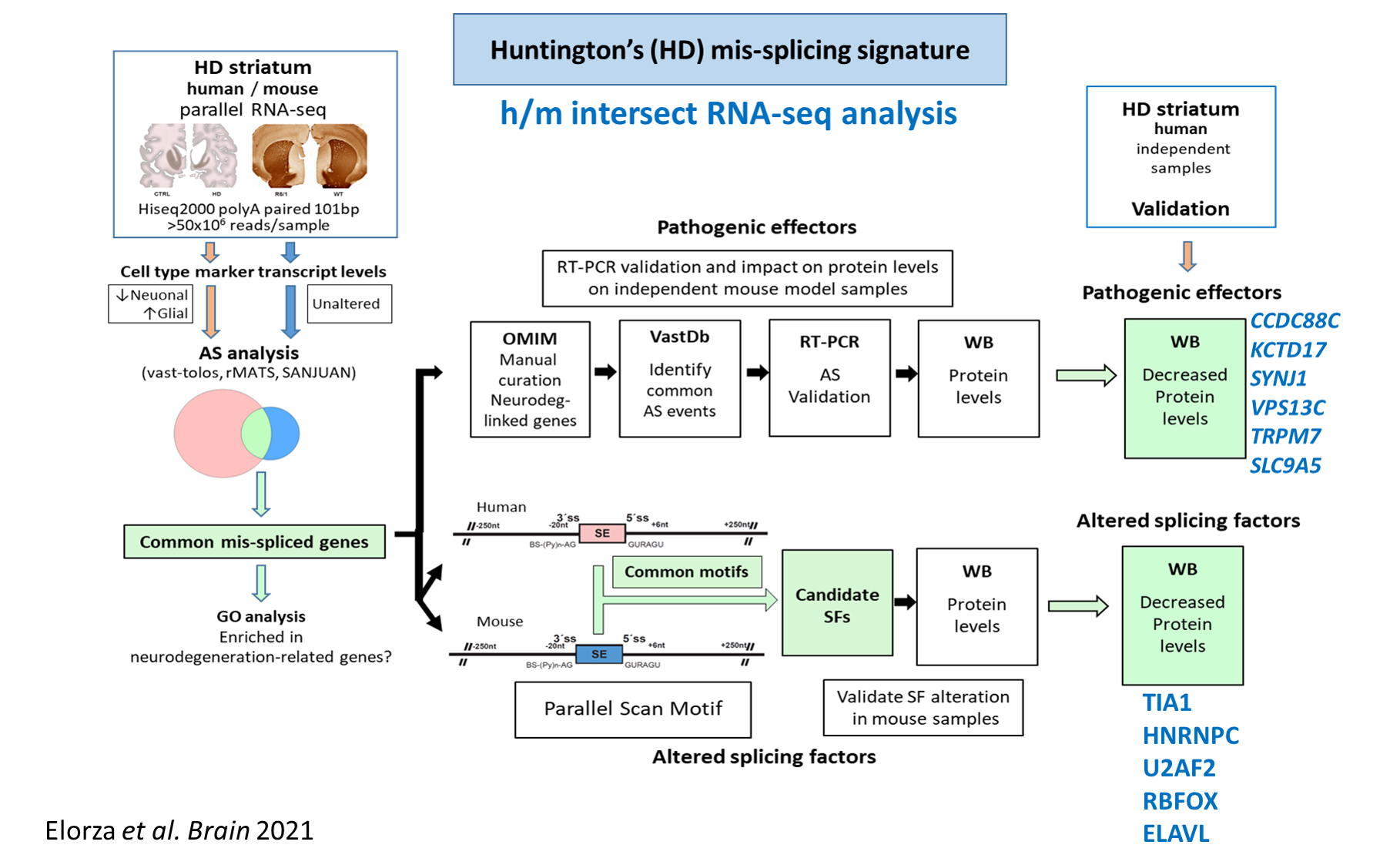
Huntington’s disease-specific mis-splicing unveils key effector genes and altered splicing factors
Ainara Elorza et al.

Autism-like phenotype and risk gene mRNA deadenylation by CPEB4 mis-splicing
Alberto Parras et al.
Título
Autores