Programa Científico
Procesos fisiológicos y patológicos
UNIDADES EN ESTE PROGRAMA
Neuropatología molecular Redes metabólicas y señalizadoras en la enfermedad
GRUPO DE INVESTIGACIÓN
Comunicación entre células y su microentorno en homeostasis y patologías a través de nodos de señalización GPCR.

Catalina Ribas Núñez
Nuestro grupo está interesado en comprender cómo las células se comunican entre sí y con su entorno en condiciones fisiológicas y patológicas, centrándonos en dos nodos de señalización de GPCRs, Gαq y GRK2. El microentorno de una célula es una combinación organizada de matriz extracelular (MEC), tejido estromal (vasos sanguíneos, células inmunitarias, fibroblastos y moléculas de señalización) que influye en el fenotipo celular a través de mecanismos físicos, mecánicos y bioquímicos. Estamos interesados en la interacción entre diferentes tipos celulares con su entorno específico en dos escenarios diferentes: (1) Entre los aspectos emergentes en la investigación sobre el cáncer se encuentran la interacción entre las células tumorales y el estroma que las rodea, y cómo estas células pueden alterar su metabolismo para sobrevivir. Sin embargo, ¿qué es lo que permite al tumor integrar ambos procesos para promover malignidad y metástasis? Teniendo en cuenta la importancia de los GPCR en cáncer y el novedoso papel de la proteína Gαq como regulador central de la autofagia, nuestros objetivos consistirán en investigar la implicación de Gαq como enlace entre ambos procesos en el contexto del cáncer oral (HNSCC). Nos centraremos en evaluar la importancia de la vía GPCR-Gαq en la regulación de la arquitectura estromal asociada al tumor por parte de los CAFs (fibroblastos asociados al tumor), así como su papel como regulador en la modulación cruzada entre la secreción de exosomas y las diferentes vías de flujo autofágico, ambos mecanismos fundamentales en la comunicación tumor-estroma. (2) La homeostasis también requiere la intercomunicación entre diferentes tipos de células en su entorno tisular, a menudo con la participación de células del sistema inmunitario. Las interacciones funcionales adecuadas entre la epidermis, la dermis y la infiltración de células inmunitarias son necesarias para una homeostasis correcta en los epitelios estratificados (como la piel o los tejidos orales). Hemos demostrado que la disminución de la expresión de GRK2 se correlaciona con la malignidad tumoral en el carcinoma epitelial de células escamosas de cabeza y cuello (HNSCC) y aumenta la invasión de las células tumorales orales en ratones. Teniendo en cuenta que la pérdida de GRK2 en los epitelios estratificados induce alteraciones en la homeostasis epidérmica, la pregunta que nos planteamos es ¿cómo se ajusta el diálogo entre los queratinocitos y su microambiente celular para facilitar respuestas coordinadas que mantengan la homeostasis contra enfermedades inflamatorias y cáncer? Para responder a estas preguntas, utilizaremos técnicas bioquímicas, de biología celular y de biología de exosomas, diferentes metodologías «ómicas» (transcriptómica, proteómica, metabolómica), microscopía de alta resolución y citometría de flujo, y sistemas de migración/invasión 2D y 3D, combinados con modelos animales con expresión alterada de Gαq o GRK2. Nuestro trabajo contribuirá a la comprensión de los mecanismos moleculares que preservan la homeostasis epitelial y conducirá al descubrimiento de nuevas dianas y enfoques terapéuticos asociados al desarrollo del HNSCC, la sexta forma de cáncer más prevalente en el mundo, con un pronóstico y una supervivencia de los pacientes muy baja.
Investigación
La comunicación célula-célula y las interacciones que se producen entre ellas son un aspecto clave en el mantenimiento de la homeostasis celular, regulando los procesos celulares individuales y las relaciones intercelulares. Cuando las células no interactúan adecuadamente o decodifican incorrectamente los mensajes moleculares se desencadena un proceso patológico.
El objetivo principal de nuestro grupo es comprender el impacto funcional, a nivel celular y de organismo, de nuevas interacciones de importantes nodos señalizadores de receptores acoplados a proteínas G (GPCR), relevantes en el mantenimiento de la homeostasis celular (ej. Gαq y GRK2), y cómo cambios en los mismos pueden afectar a la progresión de patologías, mediante el uso de modelos celulares y animales con expresión alterada/actividad de estas proteínas, así como muestras de pacientes o modelos animales de enfermedad. Nos centraremos particularmente en el impacto funcional de estas nuevas interacciones y su modulación por proteínas accesorias (como GRKs, AGS, RGS, caveolin, Ric8), en procesos de muerte celular, integración de señales de detección de nutrientes/autofagia y disfunción endotelial en el desarrollo de patologías inflamatorias/metabólicas y cáncer.
El interactoma de Gαq se ha expandido considerablemente con la descripción de nuevos efectores y nuestro grupo ha contribuido a a ello, a través de la identificación de una nueva región de interacción en Gαq, diferente de la clásica región de unión de efectores. Esta señalización no canónica de Gαq ha resultado ser relevante en el desarrollo de patologías cardiovasculares y además, resultados recientes han desvelado el novedoso papel de Gαq como modulador central de mTORC1, contribuyendo a la regulación del proceso autofágico y de esta manera al mantenimiento de la homeostasis celular, ante las fluctuaciones de nutrientes. Estas nuevas redes de interacción Gαq parecen ser importantes en la regulación de la función endotelial. Además, se sabe que Gαq interactúa con varios componentes del citoesqueleto, así como con importantes organizadores de microdominios de membrana, lo que sugiere la existencia de complejos de señalización que podrían limitarse a entornos subcelulares específicos.
A su vez, hemos desvelado también, un papel relevante de uno de los principales reguladores de estas vías de señalización Gq-GPCR, GRK2, en el mantenimiento del fenotipo epitelial de epitelios estratificados y demostrado como su ausencia contribuye al desarrollo y malignidad del carcinoma orales (HNSCC), desvelando también un importante papel de esta quinasa en la homeostasis epidérmica y en su respuesta inflamatoria.
Profundizar en una mejor comprensión de la contribución de estos nodos señalizadores a la comunicación celular entre distintos tipos celulares, tanto en condiciones fisiológicas como patológicas, regulando el tráfico de exosomas/autofagia, la disfunción endotelial/angiogénesis y el remodelado de la matriz extracelular (incluyendo: fibroblastos normales o activados (CAF), células endoteliales, células del sistema inmune y/o células tumorales), teniendo en cuenta sus respectivos secretomas, contribuirá al desarrollo de terapias más efectivas en contextos inflamatorios/metabólicos y tumorales.
Algunos de estos objetivos de investigación implican colaboraciones activas con otros miembros de nuestra Unidad en el CBMSO, así como a través de CIBER Cardiovascular (CIBER-CV, ISCIII), Red de Biomedicina Integramune, (Comunidad de Madrid), así como nuestra adscripción al Instituto de Investigación Sanitaria La Princesa
Miembros del grupo

Catalina Ribas Núñez
Lab.: 304 Ext.: 4728
cribas(at)cbm.csic.es

Inmaculada Navarro Lérida
Lab.: 304 Ext.: 4656
ilerida(at)cbm.csic.es

Ana Romo Gallo
Lab.: 320 Ext.: 4626
ana.romo(at)cbm.csic.es

Raquel Huertas Lárez
Lab.: 304 Ext.: 4656
raquel.huertas(at)cbm.csic.es

Virginia Ávila Oca
Lab.: 304 Ext.: 4656
vavila(at)cbm.csic.es

Natalia Maseda Bustillo
Lab.: 304 Ext.: 4656

Lizbeth Guadalupe Chávez Ramos
Lab.: Ext.:
Publicaciones representativas
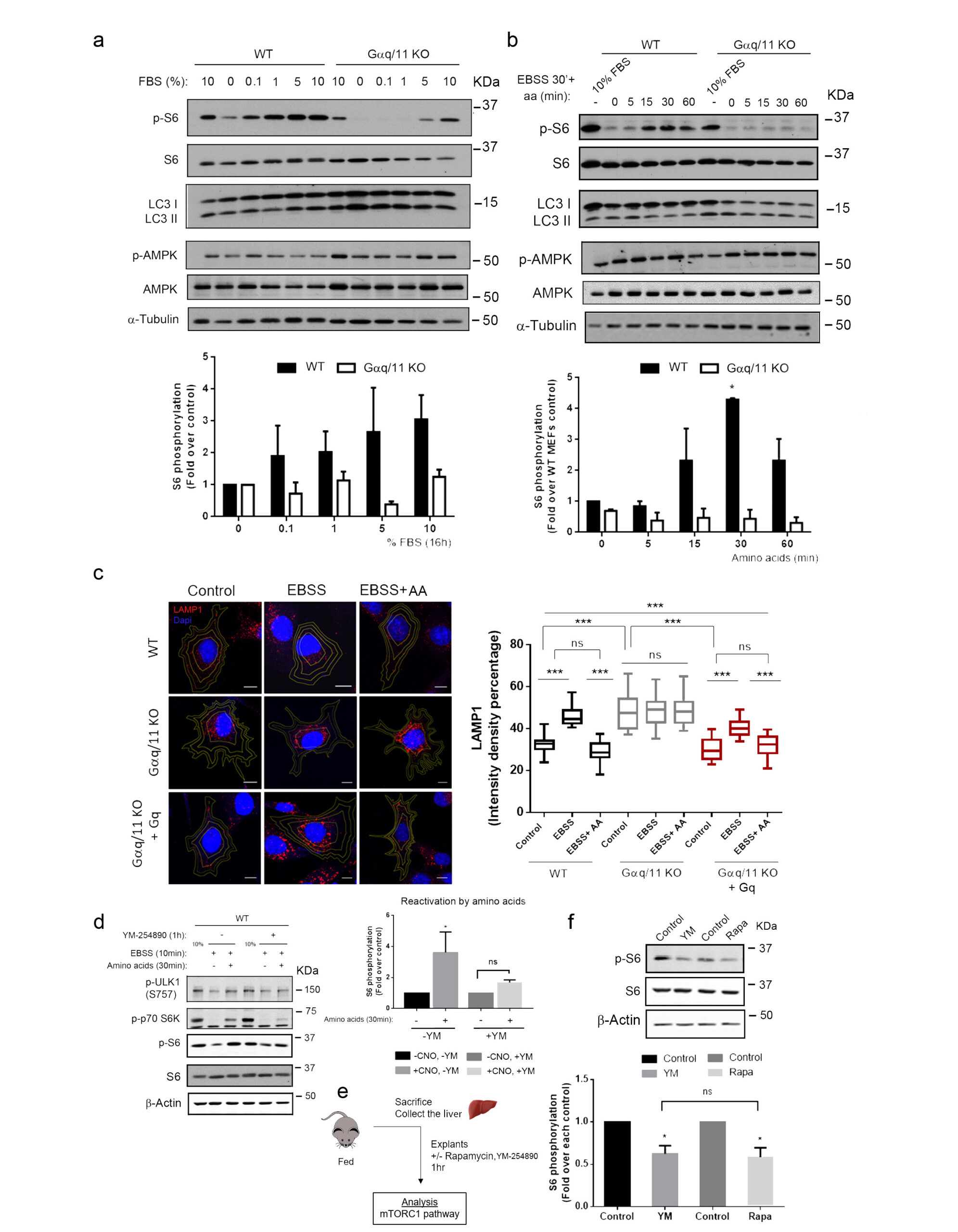
Gαq activation modulates autophagy by promoting mTORC1 signaling
Sofía Cabezudo et al.
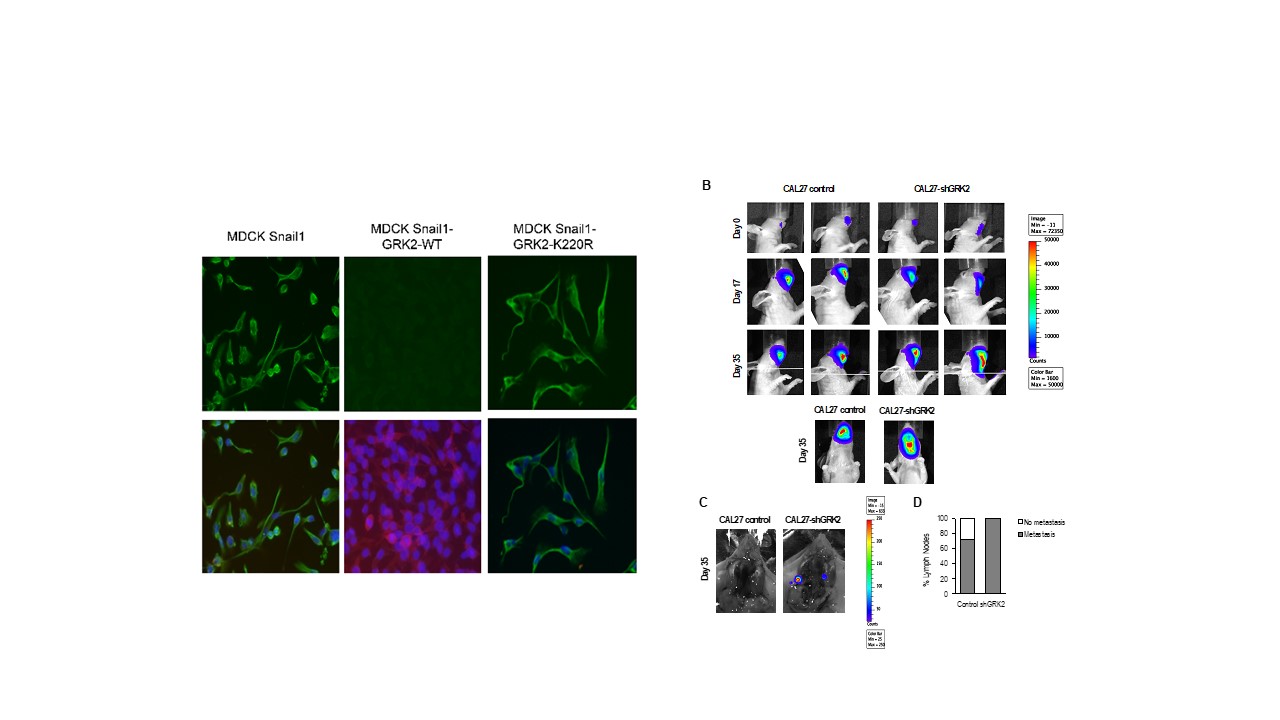
G-protein-coupled receptor kinase 2 safeguards epithelial phenotype in head and neck squamous cell carcinomas
Julia Palacios-García et al.
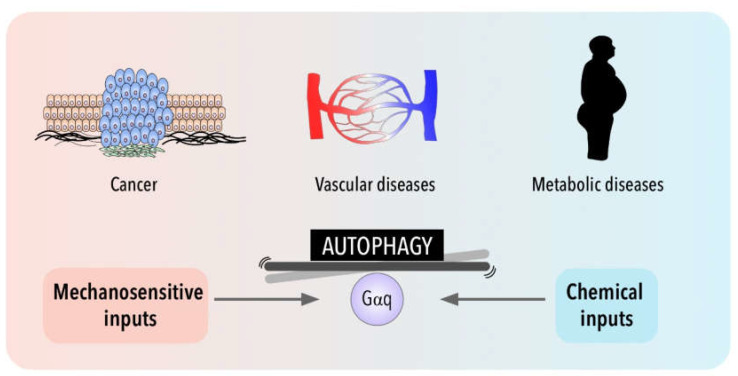
Gq Signaling in Autophagy Control: Between Chemical and Mechanical Cues
Inmaculada Navarro-Lérida et al.
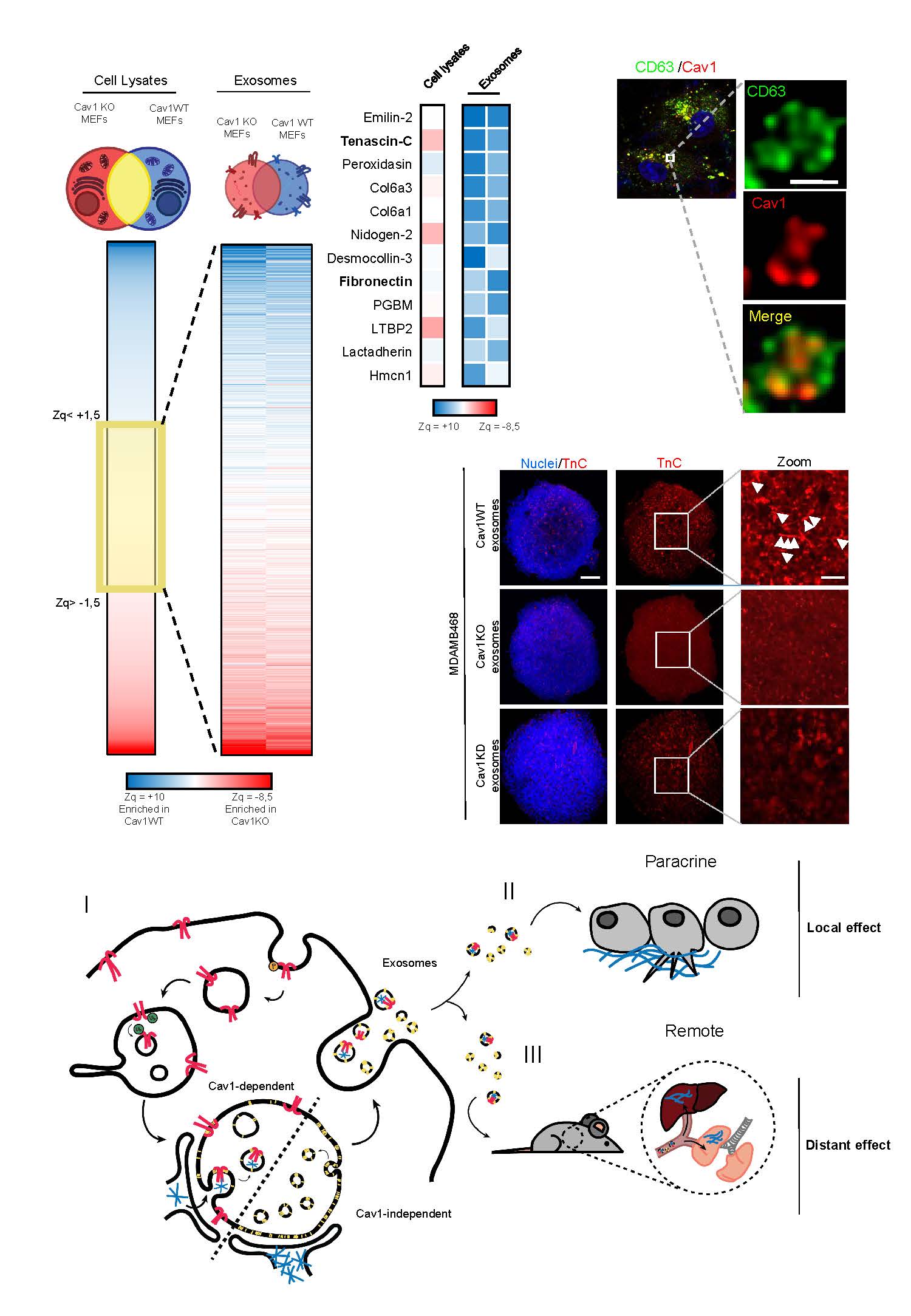
ECM deposition is driven by caveolin-1-dependent regulation of exosomal biogenesis and cargo sorting
Lucas Albacete-Albacete et al.