Programa Científico
Procesos fisiológicos y patológicos
UNIDADES EN ESTE PROGRAMA
Neuropatología molecular Redes metabólicas y de señalización en la enfermedad
GRUPO DE INVESTIGACIÓN
Papel de la biología mitocondrial en inmunomodulación

Javier Traba Domínguez
La activación y diferenciación de las células inmunes implican una compleja reprogramación metabólica en la que las mitocondrias desempeñan un papel crucial. Estos orgánulos son esenciales para suministrar energía, precursores y moléculas señalizadoras. Nuestro laboratorio trata de entender la interacción entre la función mitocondrial y la regulación tanto de la inmunidad innata como adaptativa. Nos centramos en investigar la función de proteínas mitocondriales específicas, como la Sirtuina 3 y el transportador mitocondrial de nicotinamida adenina dinucleotido, en el mantenimiento de la homeostasis mitocondrial y el funcionamiento de las células inmunes.
Investigación
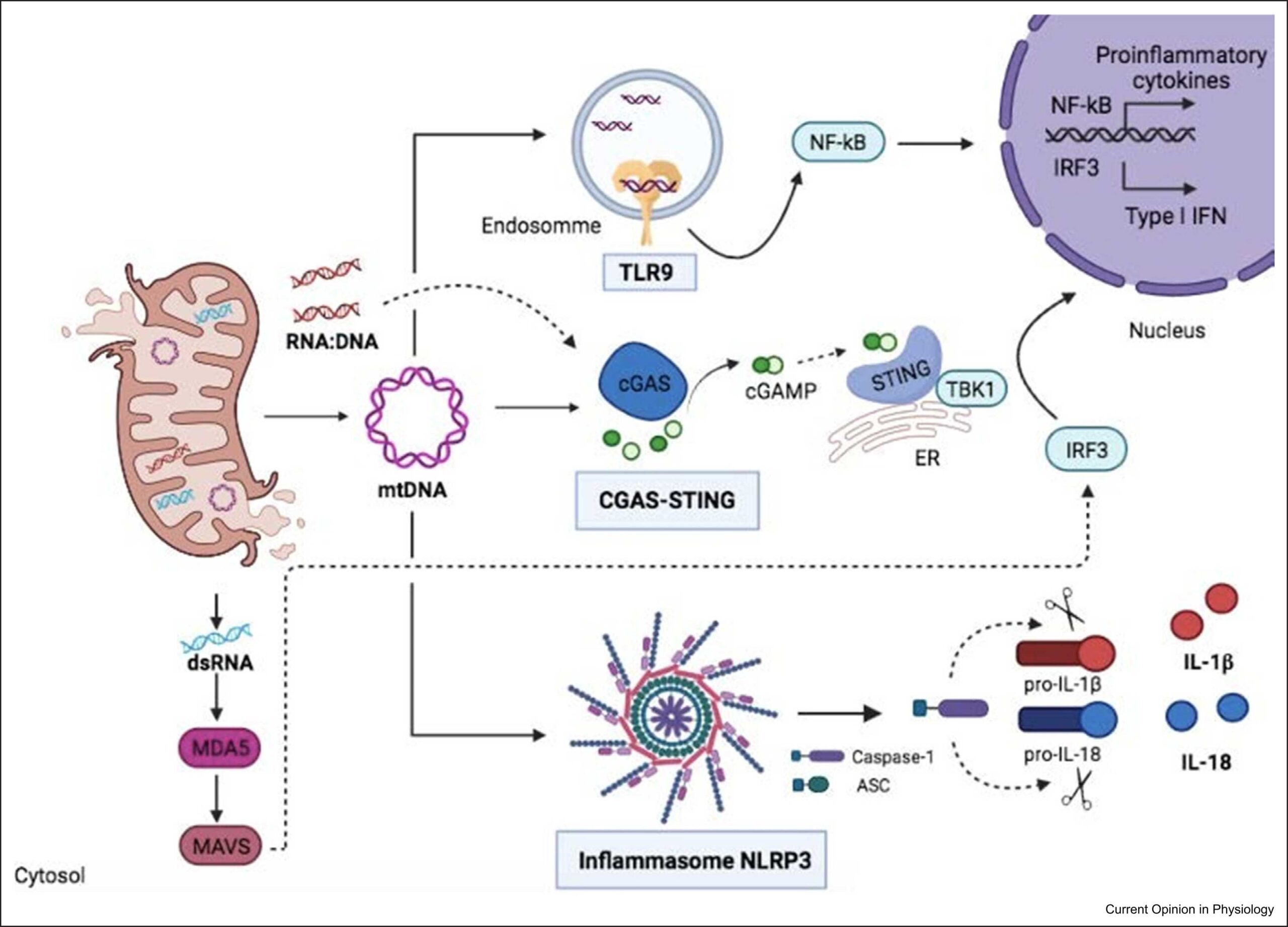
La mitocondria es considerada como la central energética de la célula pero, sin embargo, sus funciones son mucho más complejas. Además de su papel en la síntesis de ATP, también está involucrada en la generación de calor, señalización por calcio y su almacenamiento, detoxificación y señalización por especies reactivas de oxígeno (ROS), síntesis del grupo hemo y otras moléculas, y regulación de la muerte celular. Funciones emergentes de la mitocondria en enfermedad incluyen su papel como damage-associated molecular patterns (DAMPs), importantes para la inmunidad innata y adaptativa. En este contexto, la liberación de componentes mitocondriales (de origen bacteriano) al citosol, como el ADN mitocondrial, puede activar varias rutas de señalización que llevan a la secreción de citoquinas proinflamatorias (Fig. 1), un fenómeno al que se ha denominado inflamación estéril. La más estudiada de entre esas rutas es el inflamasoma NLRP3, un complejo citosólico multiproteico que detecta la presencia de ADN mitocondrial oxidado en el citosol (y por tanto funciona como un detector de disfunción mitocondrial) y que activa la caspasa 1, una enzima que a su vez corta otras proteínas, como los precursores de las citoquinas inflamatorias IL-1β y IL-18, o el inductor de piroptosis Gasdermina D, para dar lugar a sus péptidos maduros. El inflamasoma NLRP3 juega, por tanto, un papel fundamental en la inmunidad como iniciador de la respuesta inflamatoria, y está asociado a multiples enfermedades degenerativas relacionadas con el envejecimiento, como Alzheimer, asma, gota, isquemia/reperfusión, hipertensión, diabetes y psoriasis.
La mitocondria también es reconocida como un importante orgánulo sensor de nutrientes que se adapta funcionalmente dependiendo de ellos. La restricción de nutrientes provoca la activación de varias rutas y un incremento en los niveles intracelulares de nicotinamida adenina dinucleótido (NAD+), lo que activa a las sirtuinas, un grupo de enzimas con actividad deacetilasa que requiere NAD+ como cosustrato para funcionar, y por tanto son consideradas como sensores metabólicos.
Nuestra investigación ha demostrado que la restricción de nutrientes inhibe la activación del inflamasoma en macrófagos, y que este efecto depende parcialmente de la activación de SIRT3, la deacetilasa mitocondrial dependiente de NAD+. El mecanismo de acción de SIRT3 es muy interesante: al regular el estado de acetilación y la actividad de la enzima mitocondrial superóxido dismutasa (SOD2), y por tanto los niveles de ROS en la mitocondria, SIRT3 controla de manera precisa la liberación de DNA mitocondrial oxidado al citosol, donde actúa como agonista de NLRP3 (Fig. 2). Además hemos descubierto que el nicotinamida ribósido, un intermediario en la síntesis de NAD+ por la ruta de rescate, funciona como un mimético del ayuno e inhibe la liberación de IL-1β en monocitos y macrófagos, y reduce la activación de células T colaboradoras de tipo Th1 y Th17. Curiosamente, un modelo murino de psoriasis, enfermedad inflamatoria crónica de la piel ligada a la hiperactivación de las células Th17, muestra una disminución en la expression del gen de SIRT3 y en la actividad de la SOD2, y por tanto podría ser considerado como un knockdown funcional de SIRT3. La reducción en la expresión de este gen podría estar involucrada en la severidad y el fenotipo proinflamatorio observado en sus tejidos. También se conoce que la activación del inflamasoma NLRP3 y la señalización por IL-1β se asocian con la progresión de la psoriasis. Dados nuestros descubrimientos sobre el papel de SIRT3 en regulación inmune, la pregunta que nos hacemos es si precursores de NAD+ podrían mimetizar los efectos de la restricción calórica y mejorar los síntomas en una enfermedad inflamatoria. La psoriasis, enfermedad prototípica de células Th17, parece un candidato atractivo para probar esta hipótesis.
Las principales líneas de investigación de nuestro grupo son las siguientes:
Expand our studies into the fundamental role of mtDNA in innate inflammatory pathways regulated by the mitochondrial protein SIRT3, the main deacetylase in the mitochondria.
Evaluate whether NAD+ precursors blunt inflammation in a psoriatic mouse model via augmentation of mitochondrial function, fidelity and quality control programs.
Miembros del grupo

Javier Traba Domínguez
Lab.: 321 Ext.: 4622
jtraba(at)cbm.csic.es

Yara Cuesta Valero
Lab.: 321 Ext.: 4651
ycuesta(at)cbm.csic.es

Carolina Meroño Ortega
Lab.: 321 Ext.: 4651
cmeronio(at)cbm.csic.es

Aurea Oliva Herrero
Lab.: 321 Ext.: 4651
aoliva(at)cbm.csic.es

Beatriz Ballesteros Bellanco
Lab.: 321 Ext.: 4651
Publicaciones representativas
Mitochondrial function and dysfunction in innate immunity
Aurea Oliva et al.
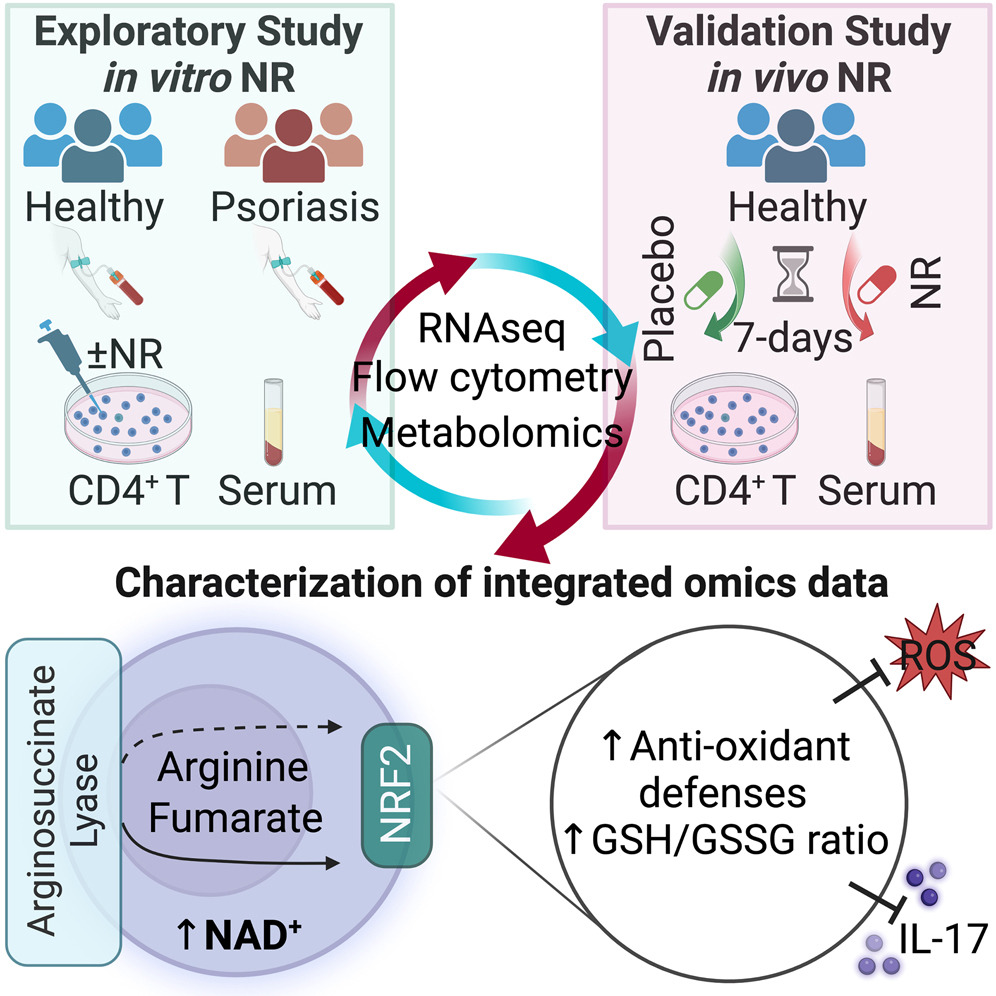
Boosting NAD preferentially blunts Th17 inflammation via arginine biosynthesis and redox control in healthy and psoriasis subjects
Kim Han et al.
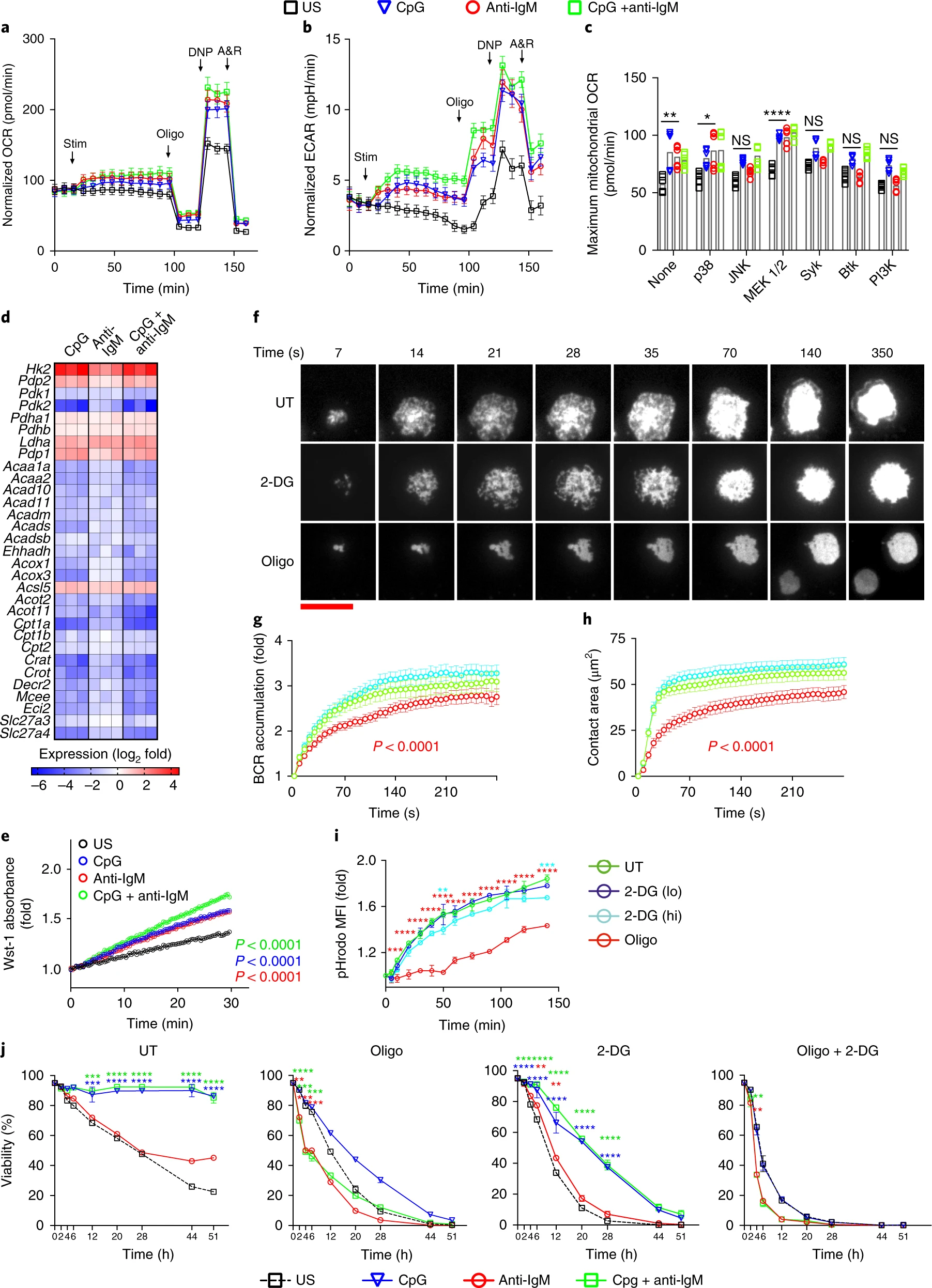
Second signals rescue B cells from activation-induced mitochondrial dysfunction and death
Munir Akkaya et al.
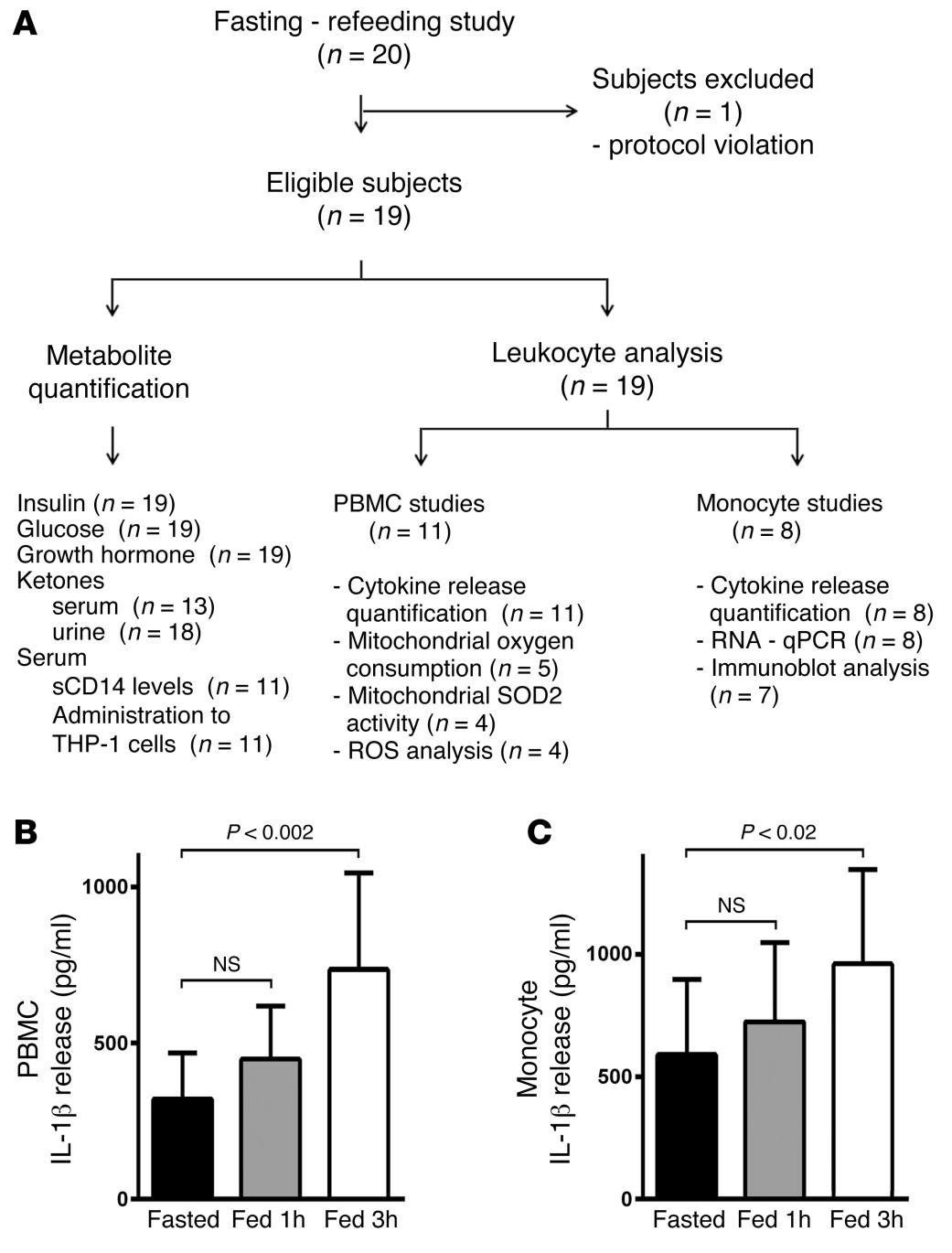
Fasting and refeeding differentially regulate NLRP3 inflammasome activation in human subjects
Javier Traba et al.