Responsable del Departamento

Sundary Sormendi Gómez
Información de contacto
91 196 44 46
transferencia.con@cbm.csic.es
Nuestros equipos multidisciplinarios llevan a cabo investigaciones en una amplia gama de campos, incluyendo infecciones virales, cáncer, neurodegeneración, desarrollo de tejidos y órganos, agrotecnología y bioprocesos. Nuestro objetivo es ofrecer soluciones innovadoras a los desafíos que enfrenta la sociedad.
Explora nuestro portafolio de tecnología protegida y contacta con nuestro Departamento de Transferencia de Conocimiento para obtener más información.
Compuesto antiviral pionero contra cepas de HSV-1 y HSV-2 resistentes al aciclovir.
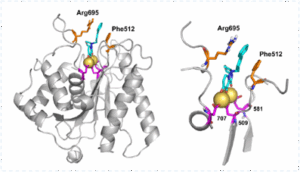 |
LN-7 es un nuevo inhibidor de endonucleasa que previene la replicación del Virus del Herpes Simple tipo 1 y 2 (HSV-1 y HSV-2) en estudios preclínicos in vitro e in vivo, postulándose como un candidato antiviral novedoso para la prevención, el tratamiento de HSV resistente a antivirales convencionales y la terapia combinada contra herpesvirus. |
|
Propiedad intelectual Solicitud de patente prioritaria presentada |
Estado de desarrollo pre-clinica in vivo |
Colaboración deseada Licencia y/o co-desarrollo |
Contacto Sundary Sormendi transferencia.con@cbm.csic.es |
Necesidad no cubierta
- 64% of population <50yo suffer with HSV-1, totaling 3,8 billion people worldwide.
- El aciclovir sigue siendo el medicamento para HSV más recetado en todo el mundo, con más de 3,8 millones de prescripciones en 2023. Mientras que el 1% de los individuos sanos presenta resistencia al aciclovir, esta cifra aumenta hasta el 15% en pacientes inmunocomprometidos. Existen tratamientos de segunda línea, como cidofovir y foscarnet, para casos resistentes a fármacos, pero presentan efectos secundarios significativos.
- El valor de mercado global de tratamientos para HSV alcanzó los 2,47 mil millones de USD en 2023, y se espera que crezca hasta 4,08 mil millones para 2030, con una tasa compuesta anual (CAGR) del 8,1%.
Solución innovadora
LN-7 es el primer antiviral de su clase contra HSV-1 que actúa sobre la endonucleasa pUL15, un componente del motor de empaquetamiento viral/complejo terminasa, utilizando piridonas policíclicas sustituidas derivadas del ácido baloxavir. Los estudios preclínicos in vivo e in vitro mostraron:
- LN-7 fue igualmente eficaz contra cepas de HSV-1 y HSV-2 resistentes al aciclovir, mostrando valores de EC50 de 3,2 y 3,6 µM, respectivamente.
- La administración combinada de LN-7 y aciclovir mostró un sinergismo sólido con un 90% de inhibición viral y un índice de reducción de dosis favorable superior a 1.
- LN-7 mostró perfiles farmacocinéticos y de seguridad excelentes para la administración intravenosa y oral en estudios in vivo (ratones y ratas).
- La administración profiláctica de LN-7 mostró títulos de HSV-1 dos veces menores en ratones infectados.
Aspectos destacados de la tecnología
- Nuevo mecanismo de acción, diferente al de otros antivirales.
- Efecto antiviral profiláctico.
- Adecuado para HSV-1 y HSV-2 resistentes al aciclovir.
- Actividad sinérgica en combinación con aciclovir.
- Candidato sólido para pacientes inmunocomprometidos.
- Seguridad y eficacia comprobadas en modelos preclínicos in vivo.
|
|
Nuevos péptidos para tratar y prevenir la deficiencia cognitiva relacionada con trastornos asociados a la edad.
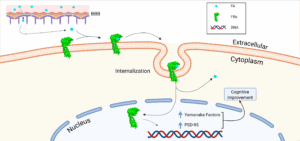 |
Nuestros novedosos péptidos se unen al receptor de folato alfa (FRα) induciendo la reprogramación y el rejuvenecimiento de las células cerebrales, mejorando la función cognitiva en ratones envejecidos. Las propiedades únicas de nuestros péptidos garantizan una unión específica al FRα, evitando cualquier efecto secundario, y son capaces de atravesar la barrera hematoencefálica, lo que permite rutas de administración versátiles. |
|
Propiedad intelectual Solicitud de patente prioritaria presentada |
Estado de desarrollo pre-clinica in vivo |
Colaboración deseada Licencia y/o co-desarrollo |
Contacto Sundary Sormendi transferencia.con@cbm.csic.es |
Necesidad no cubierta
- Las enfermedades relacionadas con la edad que afectan las funciones neuronales están en aumento debido al envejecimiento de la población, afectando a > 60 millones de personas mayores de 65 años y generando un coste anual de 1,3 billones de dólares en todo el mundo.
- La disminución de los niveles de folato está relacionada con el envejecimiento, con una prevalencia aproximada del 30 % de deficiencia de folato en personas mayores. De hecho, la deficiencia de folato está vinculada a un mayor riesgo de demencia y a un aumento de la mortalidad.
- El suplemento de folato se prescribe como tratamiento para reducir el deterioro de la memoria en personas mayores. Sin embargo, su uso es limitado debido a los efectos tóxicos asociados con una ingesta elevada.
- Se estimó que el mercado global de suplementos de folato alcanzó los 11,49 mil millones de dólares en 2024, y se espera que crezca hasta los 16,86 mil millones de dólares para 2032, con una tasa de crecimiento anual compuesta (CAGR) de aproximadamente el 4,9 %.
Solución innovadora
Nuestro enfoque patentado incluye seis nuevos péptidos de unión a FRα que se unen específicamente a FRα, induciendo su translocación al núcleo y su activación como factor de transcripción. Los estudios in vitro e in vivo mostraron:
- Expresión de los factores de Yamanaka Sox2 y Klf4, implicados en la pluripotencia y la proliferación celular.
- Aumento de los niveles de proteína PSD95, implicada en la transmisión sináptica y la cognición a través de GluN2B (subunidad del receptor NMDA) en neuronas corticales.
- Reducción de la densidad de las redes perineuronales (PNN) en el hipocampo y la neocorteza somatosensorial.
- Mejora notable en la memoria de reconocimiento de nuevos objetos, especialmente a largo plazo, pero también en la memoria espacial a corto plazo.
- Capacidad para atravesar la barrera hematoencefálica, lo que permite rutas de administración versátiles, incluyendo inyección intracraneal y peritoneal, así como inoculación intragástrica.
Aspectos destacados de la tecnología
- Modo de acción conocido, sin efectos secundarios en modelos preclínicos de ratón.
- Especificidad para FRα, evitando el efecto tóxico de dosis altas de folato.
- Permeabilidad a la barrera hematoencefálica, lo que permite rutas de administración versátiles.
- Seguridad y eficacia demostradas en modelos preclínicos de ratón.
|
|
Biotina y Tiamina: Una estrategia terapéutica novedosa para la enfermedad de Huntington.
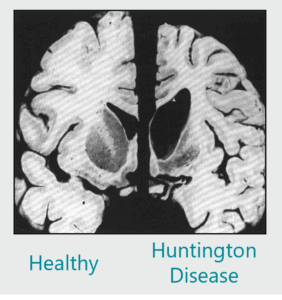 |
El metabolismo de la tiamina está alterado en la enfermedad de Huntington (HD). Nuestros estudios in vivo demostraron que el tratamiento con tiamina y biotina revierte los síntomas de la HD. Actualmente estamos evaluando la seguridad y tolerabilidad del tratamiento con tiamina-biotina para la HD en un ensayo clínico multicéntrico. |
|
Propiedad intelectual Patente concedida (EP, US) |
Estado de desarrollo fase clínica I/II |
Colaboración deseada Licencia y/o co-desarrollo |
Contacto Sundary Sormendi transferencia.con@cbm.csic.es |
Necesidad no cubierta
- Trastorno neurodegenerativo progresivo y mortal causado por una mutación genética que conduce a una función tóxica de la proteína Huntingtin.
- Con una prevalencia de 1 por cada 10.000 individuos, es una de las enfermedades raras más comunes. No existe una cura disponible. Las soluciones actualmente comercializadas son únicamente sintomáticas y están asociadas a numerosos efectos secundarios. No hay ninguna terapia aprobada por la EMA disponible.
- El valor del mercado global de tratamientos para la enfermedad de Huntington se estimó en 500 millones de dólares en 2024 y se proyecta que llegue a 1.871,2 millones de dólares para 2030 (CAGR del 23,8 %).
Solución innovadora
- Los estudios realizados con modelos de ratón y muestras de pacientes mostraron un metabolismo de la tiamina alterado en la enfermedad de Huntington, debido a la disminución de la expresión del transportador de tiamina específico del cerebro ThTr2 (SLC19A3).
- Dosis altas de tiamina y biotina atenúan la patología de la enfermedad de Huntington mediante:
- Restaurando la bioenergética cerebral (niveles de TPP) e incrementando la expresión del transportador SLC19A3.
- Previniendo la atrofia estriatal, atenuando la neuropatología y mejorando la coordinación motora.
- Datos preclínicos elegibles para la Designación de Medicamento Huérfano (ODD).
- Ensayo clínico multicéntrico en curso de fase I/II para evaluar la seguridad y tolerabilidad del tratamiento con tiamina y biotina para la enfermedad de Huntington (NCT04478734).
Aspectos destacados de la tecnología
- Mejora de la neuropatología, radiología y síntomas motores en un modelo murino de la enfermedad de Huntington (HD).
- Seguridad comprobada y buena tolerabilidad en humanos.
- Buena adherencia al tratamiento en humanos.
- Elegible como ODD
- Permite la terapia combinada con otros tratamientos.
|
|
Biomarcador para el diagnóstico y pronóstico de la esclerosis múltiple (EM).
 |
Una isoforma de TAF1, en la que se pierde el extremo C-terminal, desregula la expresión de genes implicados en la neuropatología de la esclerosis múltiple (EM). La detección de esta isoforma en sangre y/o líquido cefalorraquídeo puede utilizarse como biomarcador para el diagnóstico y pronóstico de la EM. La nueva línea murina que expresa esta isoforma puede emplearse para validar nuevas terapias contra la EM. |
|
Propiedad intelectual Solicitud de patente prioritaria presentada |
Estado de desarrollo pre-clinica in vivo |
Colaboración deseada Licencia y/o co-desarrollo |
Contacto Sundary Sormendi transferencia.con@cbm.csic.es |
Necesidad no cubierta
- La esclerosis múltiple (ES) es una enfermedad autoinmune crónica de etiología desconocida, caracterizada por neuroinflamación, desmielinización y daño axonal, que afecta a 2,9 millones de personas en todo el mundo.
- El 40 % de los pacientes son diagnosticados en >5 años desde la aparición de los primeros síntomas de la EM.
- Aunque existen tratamientos modificadores de la enfermedad en las primeras etapas, no hay cura.
- Principales desafíos para un diagnóstico y tratamiento eficaces están relacionados con la falta de:
- comprensión de la compleja base molecular de la enfermedad.
- diagnóstico temprano y de biomarcadores para el pronóstico de la progresión de la EM.
- modelos preclínicos para la investigación y desarrollo de nuevas terapias.
Solución innovadora
Nuestros estudios preclínicos identifican una isoforma de TAF-1 que carece del extremo C-terminal (TAF1ex38) como un biomarcador candidato para el diagnóstico y pronóstico de la esclerosis múltiple (EM).
- La materia gris y blanca de apariencia normal (NAG+WM) de pacientes con EM mostró una presencia reducida de TAF1ex38.
- Los niveles reducidos de TAF1ex38 pueden explicarse por una mayor actividad de la catepsina B fuera de los lisosomas en el tejido cerebral de pacientes con EM.
- Los niveles disminuidos de TAF1ex38 estaban relacionados con la progresión de la EM.
- Primer modelo murino de EM progresiva, en el que la eliminación de TAF1ex38 imita la fisiopatología de la EM.
- El extremo C-terminal de TAF1 interactúa con múltiples reguladores transcripcionales implicados en la iniciación de la transcripción por RNAPII y en la liberación de la pausa, y su ausencia conduce a la disminución de la expresión de genes de oligodendroglía y al aumento de la expresión de genes inflamatorios.
Aspectos destacados de la tecnología
- Nuevo biomarcador para diagnóstico y pronóstico.
- Método mínimamente invasivo mediante extracción de sangre o líquido cefalorraquídeo.
- Mecanismo molecular de acción conocido.
- Nuevo modelo preclínico para la EM.
|
|
|
Inmunoterapia dirigida para la leucemia linfoblástica aguda de células T (T-ALL).
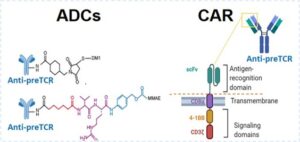 |
Desarrollo y validación de una nueva estrategia de inmunoterapia basada en la administración de ADCs o células CAR-T derivadas de un anticuerpo monoclonal dirigido contra el receptor pre-TCR, lo que reduce la actividad de LIC y la progresión tumoral, en un modelo preclínico de xenotrasplante humano de T-ALL en ratones. |
|
Propiedad intelectual Solicitud PCT presentada. |
Estado de desarrollo pre-clinica in vivo |
Colaboración deseada Licencia y/o co-desarrollo |
Contacto Sundary Sormendi transferencia.con@cbm.csic.es |
Necesidad no cubierta
- La leucemia linfoblástica aguda de células T (T-ALL) presenta una progresión agresiva y un pronóstico desfavorable en pacientes con recaída.
- 65 % de recaídas tempranas tras la terapia de primera línea (antes de 18 meses) con <10% de supervivencia a largo plazo.
- Los tratamientos actuales se basan en quimioterapia y trasplante de células madre, los cuales ofrecen una especificidad limitada y una alta toxicidad.
- Las inmunoterapias dirigidas, como CAR-T y los anticuerpos monoclonales, enfrentan desafíos debido a la falta de dianas tumorales específicas, lo que provoca aplasia de células T y fratricidio de CAR-T.
- El mercado global de tratamientos para T-ALL se estimó en 3,3 mil millones de USD en 2023, y se espera que crezca hasta 5,4 mil millones de USD para 2035, con una tasa de crecimiento anual compuesta (CAGR) de aproximadamente 4,19 %.
Solución innovadora
Nuestra tecnología patentada se dirige al pre-TCR, un receptor expresado en >50% de los casos de T-ALL pero ausente en las células T periféricas sanas, lo que permite una acción selectiva sobre las células malignas, incluidas aquellas que presentan actividad de células iniciadoras de leucemia (LIC).
- Enfoque terapéutico dual:
- Conjugados anticuerpo-fármaco (ADCs) para la administración dirigida de toxinas.
- Células CAR-T diseñadas para reconocer el pre-TCR.
- Ventaja comparativa:
-
- A diferencia de las terapias CAR-T dirigidas a CD7/CD5, que conllevan el riesgo de una aplasia de células T potencialmente mortal debido a la expresión compartida de antígenos, la orientación hacia el pre-TCR evita la eliminación de células T sanas.
- Selectividad y eficacia superiores en modelos preclínicos de xenoinjertos demostrada.
- La internalización dinámica del pre-TCR mejora la captación del ADC y la potencia terapéutica.
Aspectos destacados de la tecnología
- Orientación selectiva hacia las células iniciadoras de leucemia (LICs), clave para reducir la recaída.
- Evita la aplasia de células T potencialmente mortal y el canibalismo entre células CAR-T.
- Bajo riesgo de mutantes de escape debido al papel del objetivo en la supervivencia de las células T-ALL.
- Validado en modelos de ratón con xenoinjertos humanos.
|
|
