Investigadores del Centro de Biología Molecular Severo Ochoa (CBM-CSIC-UAM), en colaboración con la Universidad Pablo de Olavide y la VU University Amsterdam, han identificado un nuevo mecanismo que contribuye al desarrollo temprano de la enfermedad de Alzhéimer, mucho antes de la aparición de los signos clásicos de la enfermedad. El hallazgo ha sido publicado en la revista Cell Reports.
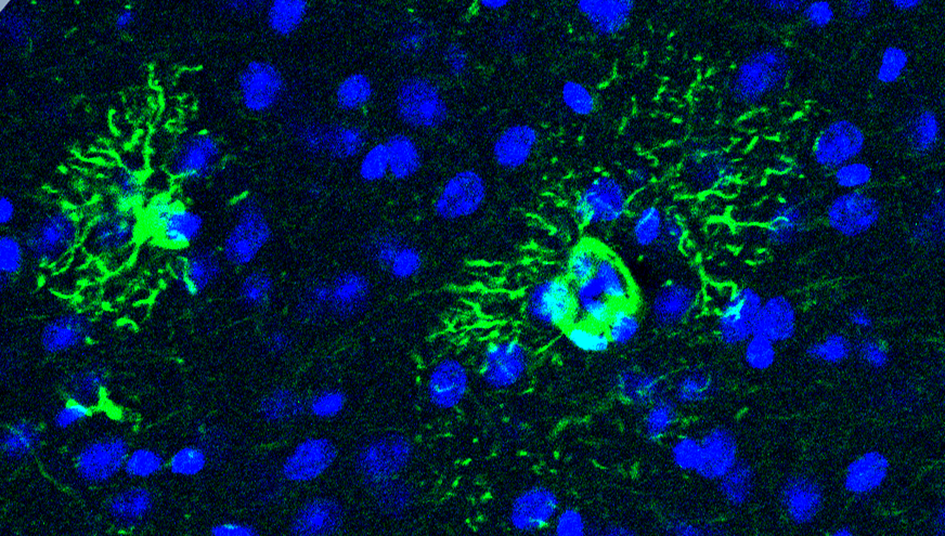
El estudio pone el foco en los astrocitos, células gliales del cerebro que durante mucho tiempo fueron consideradas como meros ayudantes de las neuronas. Sin embargo, los investigadores han demostrado en un modelo de ratón que los astrocitos pueden desempeñar un papel clave en el origen de la enfermedad de Alzhéimer, a través de la producción excesiva de una proteína llamada SFRP1.
En condiciones normales, la proteína SFRP1 regula la comunicación entre células durante el desarrollo cerebral. Sin embargo, su acumulación en el cerebro adulto, como ocurre durante procesos inflamatorios crónicos asociados al envejecimiento o a la enfermedad de Alzhéimer, tiene efectos perjudiciales.
En exceso, SFRP1 bloquea la actividad de una enzima, es decir, una proteína que facilita y acelera funciones en el cerebro, denominada ADAM10, necesaria para mantener sanas las conexiones neuronales (sinapsis). Este bloqueo genera un desequilibrio que deteriora la plasticidad sináptica, un mecanismo celular esencial para formar y consolidar recuerdos que permite a las neuronas regular su conectividad en respuesta a diferentes estímulos.
Además, este trabajo muestra cómo el exceso de SFRP1 interfiere con un proceso fundamental para el aprendizaje y la memoria, denominado potenciación sináptica a largo plazo (LTP, por sus siglas en inglés). Este proceso permite que las conexiones entre neuronas se fortalezcan cuando se usan repetidamente, facilitando la consolidación de nuevos recuerdos. Si este mecanismo se debilita —como ocurre en el modelo experimental del estudio—, las neuronas no pueden comunicarse eficazmente y dificulta la formación de la memoria, un rasgo característico en las fases iniciales de la enfermedad de Alzhéimer.
A diferencia de terapias que se enfocan en eliminar placas amiloides, hasta ahora consideradas uno de los principales marcadores de la enfermedad de Alzheimer, esta investigación abre la posibilidad en un futuro de actuar en una etapa silenciosa pero crítica de la enfermedad, cuando las neuronas aún podrían recuperarse.
Un enfoque innovador para combatir el alzhéimer
Uno de los aspectos menos estudiados de la enfermedad de Alzheimer es la contribución de las células gliales a la patología neuronal, y en particular a los primeros cambios observables en los cerebros de los pacientes y en modelos animales, antes del inicio de la degeneración neuronal.
Las células de glía, entre ellas los astrocitos, aunque no están involucradas directamente en transmitir señales como las neuronas, proporcionan soporte físico a estas y mantienen la arquitectura del sistema nervioso, por lo que tienen un papel crucial en el correcto funcionamiento del cerebro. Son como asistentes que protegen, alimentan y apoyan a las neuronas.
El estudio revela que la proteína SFRP1, producida por los astrocitos, induce alteraciones estructurales en las sinapsis neuronales que preceden a la pérdida de memoria y a la acumulación de placas amiloides. Estas alteraciones incluyen una reducción en la complejidad dendrítica (estructura ramificada que utilizan las neuronas para recibir información de otras neuronas) y una disfunción sináptica. Además, se correlacionan fuertemente con el deterioro cognitivo, mucho más que la presencia de placas amiloides: afectan directamente a la capacidad de aprendizaje y memoria.
Una nueva diana terapéutica
Para explorar el papel de esta proteína, los investigadores desarrollaron un modelo en ratones en el que se induce la sobreexpresión de la proteína SFRP1 específicamente en astrocitos, un tipo de célula glial. Esta manipulación fue suficiente para provocar una progresiva pérdida de espinas sinápticas en el hipocampo, región clave para la memoria, así como una rigidez en las conexiones neuronales que limita su capacidad de adaptación a nuevas experiencias.
“El aumento de SFRP1 en etapas tempranas parece actuar como un motor activo de la patología, no como un simple acompañante de otros procesos degenerativos”, explica Guadalupe Pereyra, autora del estudio. De hecho, estudios previos ya habían detectado niveles elevados de esta proteína en el cerebro y en el líquido cefalorraquídeo de pacientes con la enfermedad de Alzhéimer, incluso antes del diagnóstico clínico.
Además, el análisis proteómico del estudio muestra que la acumulación de SFRP1 altera la sinapsis: afecta profundamente al ciclo de vesículas presinápticas, que son esenciales para la comunicación entre neuronas, y aumenta la presencia de proteínas como la neurexina, implicadas en la adhesión sináptica. Esta disrupción compromete la plasticidad neuronal y, por tanto, la consolidación de recuerdos.
Estos hallazgos posicionan a SFRP1 como una diana terapéutica emergente en la lucha contra la enfermedad de Alzhéimer, con el potencial de intervenir en fases tempranas de la enfermedad, antes de que se produzcan daños neuronales irreversibles.
Referencia
Guadalupe Pereyra, María Inés Mateo, Pablo Miaja, María Jesús Martin-Bermejo, Marcos Martínez-Baños, Remco Klaassen, Agnés Gruart, Javier Rueda-Carrasco, Alba Fernéndez-Rodrigo,1 Esperanza López-Merino, Pilar Esteve, José A. Esteban, August B. Smit, José M. Delgado-García, and Paola Bovolenta. SFRP1 upregulation causes hippocampal synaptic dysfunction and memory impairment. Cell Reports. DOI: https://doi.org/10.1016/j.celrep.2025.115535
Contacto
CBM Comunicación – comunicacion@cbm.csic.es