Un equipo del Centro de Biología Molecular Severo Ochoa (CBM, CSIC-UAM), junto a la Universidad de Queensland (Australia) y la Universidad de Milán (Italia), ha identificado una nueva enzima llamada SddA, que regula la separación de las células hijas durante la división de bacterias Gram-negativas. En este grupo se encuentran bacterias, como Escherichia coli, que conviven normalmente en nuestro microbioma, pero que bajo determinadas condiciones pueden actuar como patógenos capaces de causar infecciones intestinales, urinarias o incluso cuadros graves de sepsis.
Las bacterias Gram-negativas tienen una envoltura celular compleja: dos membranas lipídicas que rodean una fina pared celular llamada peptidoglicano, compuesta por azúcares y péptidos. Esta pared celular es esencial para su supervivencia y, de hecho, su síntesis es diana de multitud de antibióticos utilizados en la actualidad.
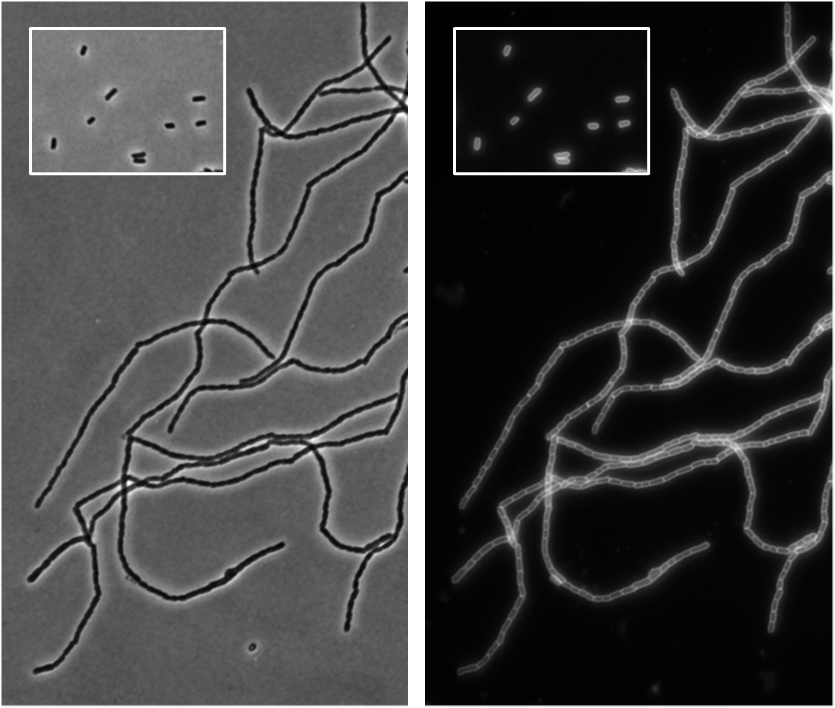
Durante su ciclo de vida, estas bacterias crecen en longitud y se dividen, dando lugar a dos células idénticas. Para lograrlo, deben remodelar su pared celular. Durante su división la bacteria forma un septo de peptidoglicano, una pared transversal que separará a las futuras bacterias hijas. Para que la separación sea completa, el septo debe hidrolizarse por acción de enzimas amidasas, las cuales rompen los enlaces entre azúcares y péptidos. Su acción genera cadenas de peptidoglicano “desnudas”, listas para ser procesadas por enzimas hidrolíticas adicionales.
El hallazgo del equipo ha revelado que la enzima SddA modifica químicamente esas cadenas desnudas a través de su actividad deacetilasa —una reacción que altera los azúcares del peptidoglicano—, y regula la acción de las amidasas, controlando de forma precisa el proceso de división.
El equipo comprobó que SddA se concentra en la zona de división y que, cuando se produce en exceso, bloquea la separación normal de las células, formando largas cadenas de células bacterianas interconectadas.
“El descubrimiento de SddA nos revela un mecanismo de regulación desconocido hasta ahora, y nos ayuda a entender mejor cómo las bacterias coordinan la división y síntesis de su pared celular, una de las dianas más explotadas por los tratamientos antibióticos actuales” explica Manuel Pazos, investigador del CBM y uno de los autores de correspondencia del estudio.
Este avance no solo ayuda a comprender mejor la biología de bacterias que forman parte de nuestro microbioma —y que en ciertas condiciones se convierten en patógenos peligrosos—, sino que también sienta las bases para explorar nuevas dianas terapéuticas en la lucha contra las infecciones.
Referencia
Hernández-Rocamora VM, Martorana AM, Belloso A, Ballesteros D, Zaccaria M, Perez AJ, et al. (2025) A novel peptidoglycan deacetylase modulates daughter cell separation in E. coli. PLoS Genet 21(9): e1011626. https://doi.org/10.1371/journal.pgen.1011626