Programa Científico
Procesos fisiológicos y patológicos
GRUPO DE INVESTIGACIÓN
Señalización por calcio en la mitocondria: Control metabólico y fisiopatología mitocondrial
El metabolismo celular y mitocondrial están conectados a través de los transportadores mitocondriales (MCs) que intercambian metabolitos entre la mitocondria y el citosol. Un grupo de MCs (CaMCs) transportan aspartato, glutamato o nucleótidos de adenina, y presentan dominios de unión a calcio orientados al citosol. Nuestro objetivo es comprender cómo los CaMCs controlan el metabolismo de tejidos específicos como cerebro e hígado y si actúan o no como transductores de señales de calcio citosólico a la mitocondria.
Investigación
El interés de nuestra investigación reside en comprender la regulación por calcio de la actividad mitocondrial mediada por los transportadores mitocondriales de aspartato/glutamato (AGCs), componentes de la lanzadera de malato/aspartato (MAS) o de ATP-Mg2+/Pi (SCaMCs). Estos transportadores presentan dominios de unión a calcio orientados hacia el espacio intermembrana y que no son activados por el calcio de la matriz mitocondrial. También nuestro objetivo es conocer el papel fisiológico de estos transportadores y sus implicaciones patológicas.
En las neuronas, se considera que el calcio regula la activación neuronal ajustando la producción de ATP al consumo de ATP. Esto ocurre gracias a la estimulación de la glucólisis y los procesos de fosforilación oxidativa (OXPHOS). Se creía que el uniportador de calcio mitocondrial (MCU) desempeñaba un papel importante al aumentar el calcio mitocondrial y la actividad OXPHOS en respuesta a la activación. Hemos probado esta posibilidad y hemos descubierto que MCU no se requiere para aumentar la respiración mitocondrial en respuesta a la estimulación en neuronas que utilizan glucosa. En cambio, utilizando sensores intracelulares de glucosa, piruvato y lactato, encontramos que se requiere Aralar/AGC1-MAS para estimular la glucólisis, la producción de piruvato y la respiración, indicando que representan un mecanismo dependiente de calcio esencial para estimular la glucólisis y la respiración en las neuronas usando glucosa. Nuestro objetivo actual es estudiar el papel de Citrin/AGC2 en el hígado en la respuesta mitocondrial a agonistas movilizadores de Ca2+.
La deficiencia de Aralar es una enfermedad rara que cursa con deterioro del neurodesarrollo, epilepsia e hipomielinización. Hemos explorado tratamientos para esta enfermedad y hemos descubierto que el β-hidroxibutirato (βOHB), el principal producto metabólico de las dietas cetogénicas, es capaz de superar el defecto en la respiración, tanto basal como estimulada por cargas de trabajo, en neuronas con deficiencia de Aralar/AGC1 y que revierte parcialmente su incapacidad para producir aspartato y NAA. La administración in vivo de βOHB a ratones Aralar-KO aumenta los niveles de proteínas de mielina y de marcadores dopaminérgicos en estos ratones, sugiriendo la administración de βOHB como un tratamiento potencial para la deficiencia de Aralar/AGC1.
Sin embargo, no está claro si el defecto en la mielinización del ratón Aralar-KO se debe a la falta de Aralar/AGC1 en las neuronas o en los oligodendrocitos. Nuestro objetivo actual es generar ratones Aralar-KO específicos de neuronas u oligodendrocitos para abordar estos problemas.
La deficiencia de Citrin es un trastorno del ciclo de la urea con diferentes manifestaciones clínicas. Citrin/AGC2 se expresa principalmente en el hígado. En el marco de la Fundación Citrin, estamos explorando la expresión exógena de Aralar, que tiene baja expresión en hígado normal, como posible terapia para la deficiencia de Citrin. Hemos generado ratones Citrin-KO que portan un transgén para Aralar/AGC1 con expresión específica de hígado y estamos estudiando su efecto en la recuperación de la actividad MAS del hígado y otros rasgos de la deficiencia de Citrin reproducidos en ratones Citrin-KO.
Un proyecto de COVID-19 (CvK) en curso tiene como objetivo desarrollar una terapia contra los síntomas de COVID-19 con el uso de senolíticos, que eliminarían selectivamente las células senescentes de los organismos.
Miembros del grupo

Jorgina Satrústegui Gil-Delgado
Lab.: 321 Ext.: 4621
jsatrustegui(at)cbm.csic.es

José Mª Carrascosa Baeza
Lab.: 114.2 Ext.: 4651
jmcarrascosa(at)cbm.csic.es

Araceli del Arco Martínez
Lab.: 321 Ext.: 4651
adelarco(at)cbm.csic.es

Beatriz Pardo Merino
Lab.: 321 Ext.: 4635
bpardo(at)cbm.csic.es

Cayetano-Alfonso Von-Kobbe Alonso
Lab.: 114.4 Ext.: 4809
cvonkobbe(at)cbm.csic.es

Laura Contreras Balsa
Lab.: 321 Ext.: 4651
lcontreras(at)cbm.csic.es

Luis González Moreno
Lab.: 321 Ext.: 4651
lgmoreno(at)cbm.csic.es

Ismael García Lobo
Lab.: 321 Ext.: 4651
ismael.garcia(at)cbm.csic.es

Raúl García Martínez
Lab.: 321 Ext.: 4651
raul.garcia.martinez(at)cbm.csic.es

Samuel Esteban Prieto
Lab.: 321 Ext.: 4635

Isaac Yunta Cantarero
Lab.: 321 Ext.: 4635
Publicaciones representativas
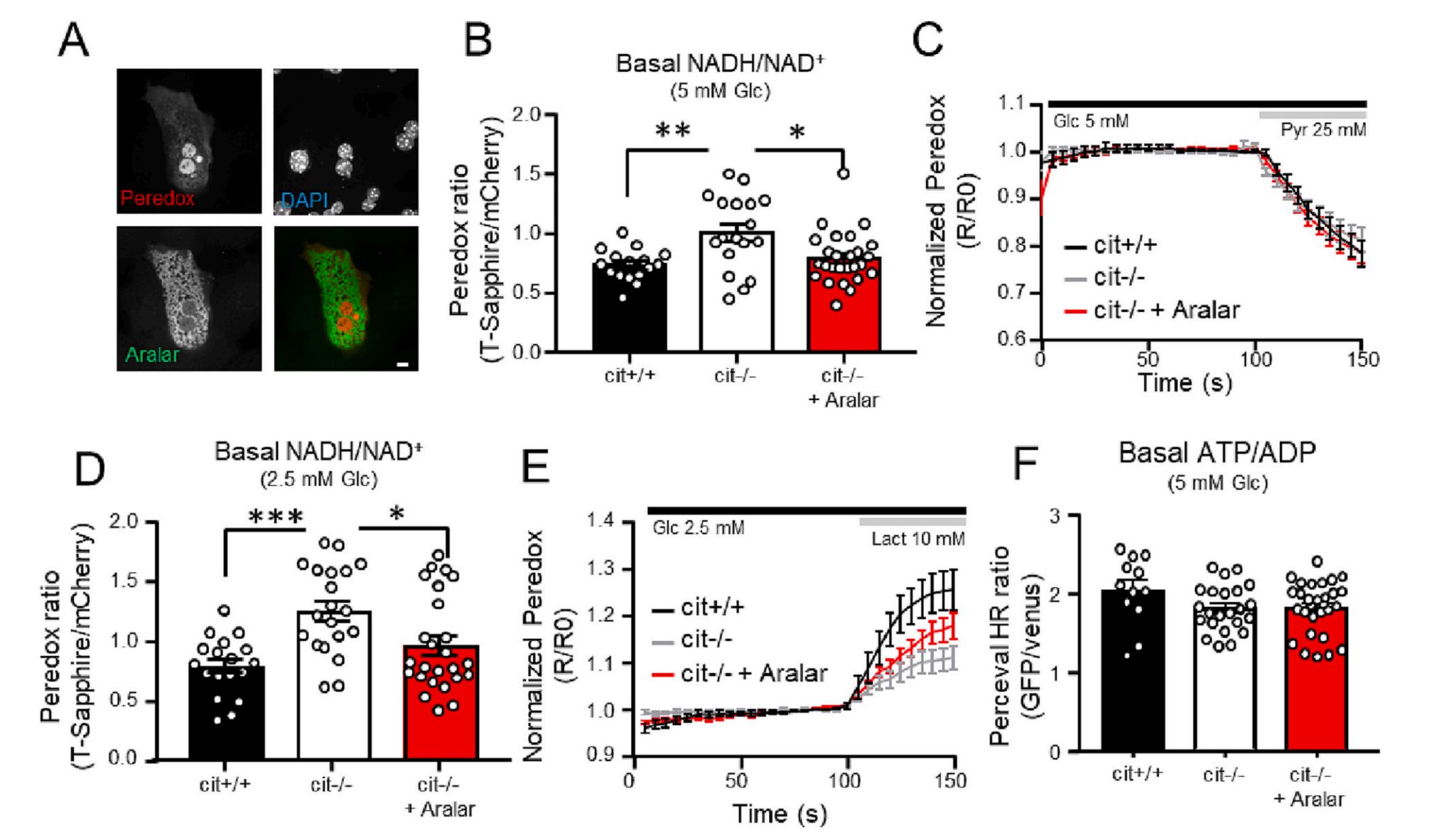
Exogenous aralar/slc25a12 can replace citrin/slc25a13 as malate aspartate shuttle component in liver
Luis González-Moreno et al.
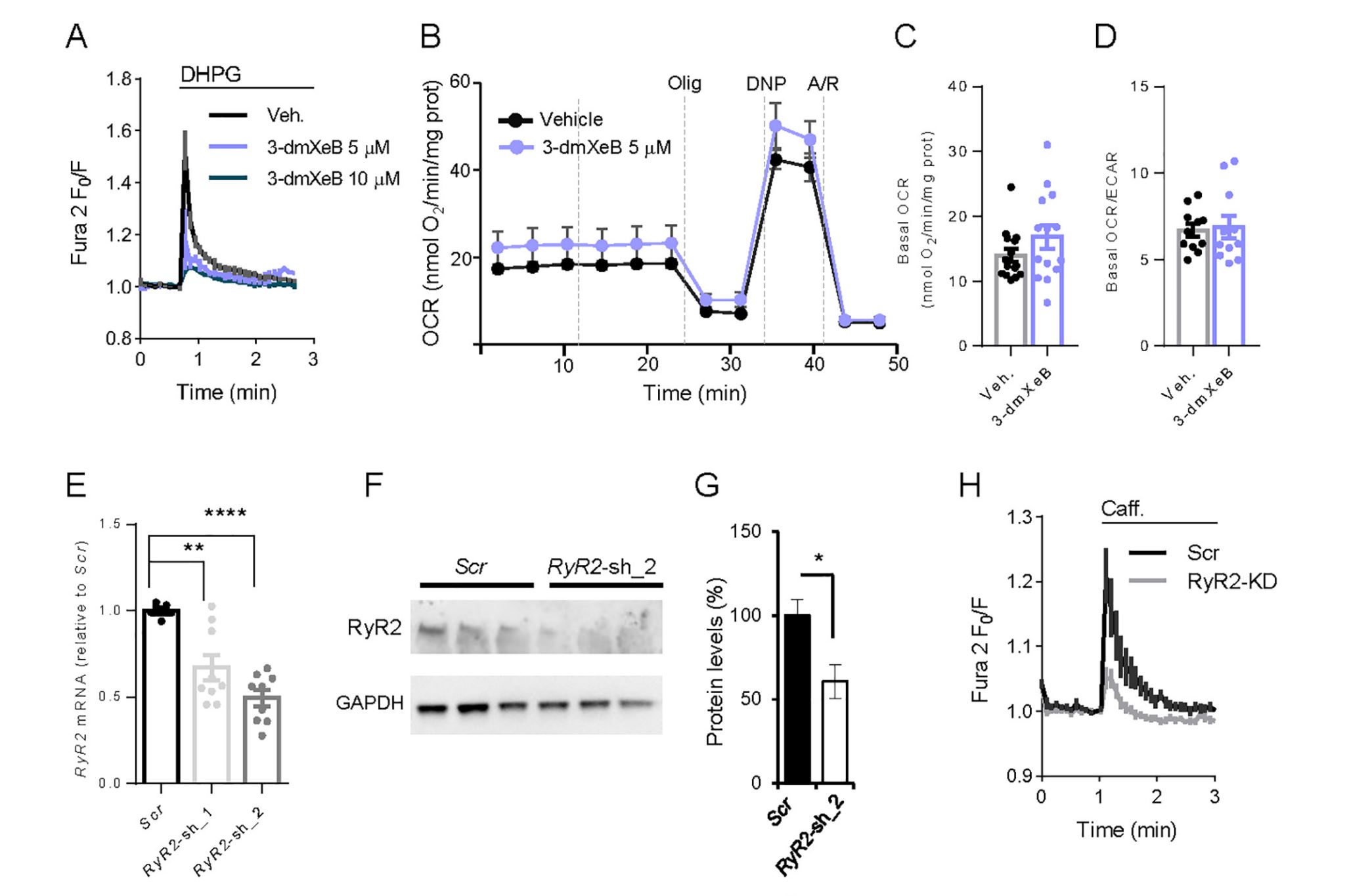
A Ca2+-Dependent Mechanism Boosting Glycolysis and OXPHOS by Activating Aralar-Malate-Aspartate Shuttle, upon Neuronal Stimulation
Irene Pérez-Liébana et al.
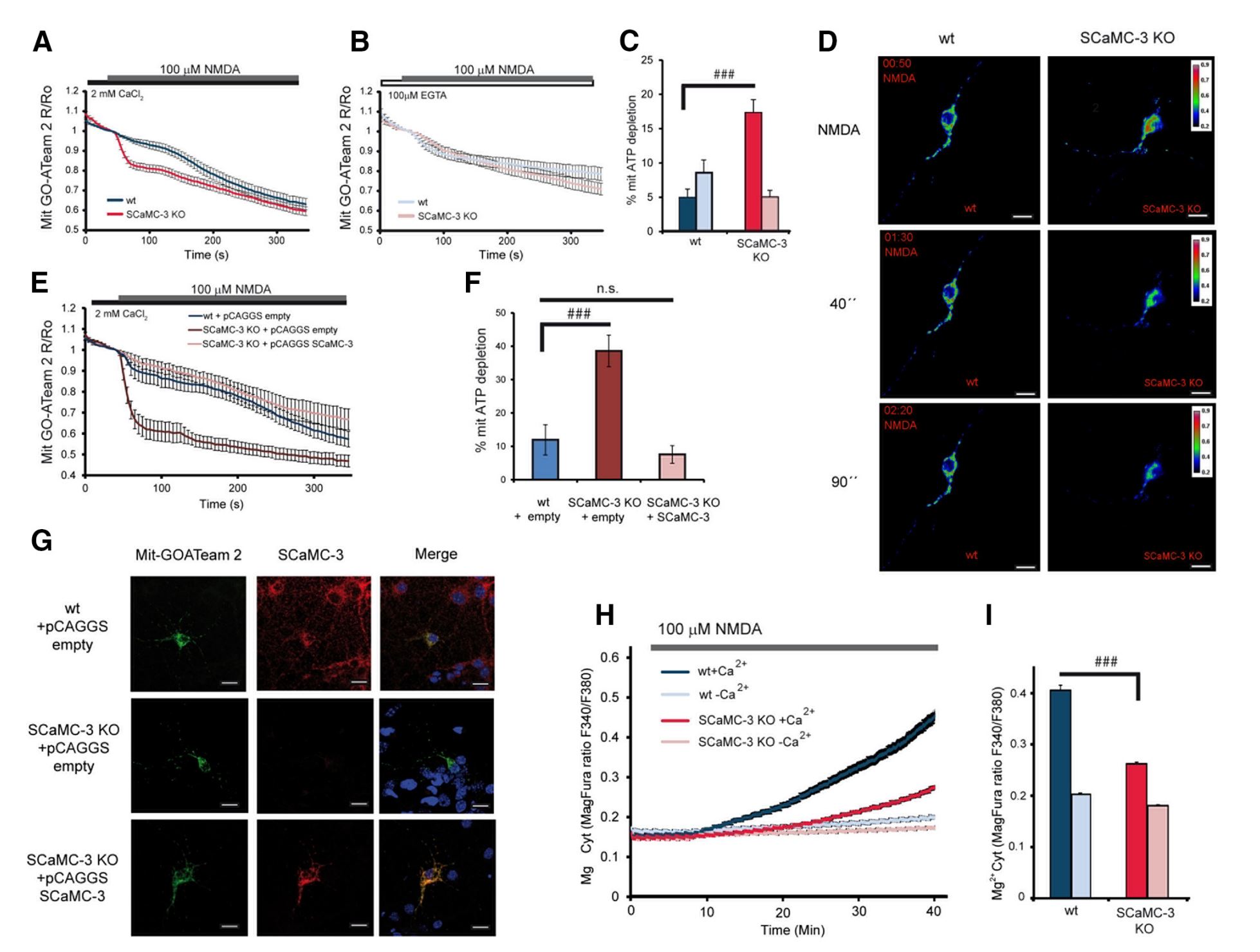
Mitochondrial ATP-Mg/Pi Carrier SCaMC-3/Slc25a23 Counteracts PARP-1-Dependent Fall in Mitochondrial ATP Caused by Excitotoxic Insults in Neurons
Carlos B. Rueda et al.
Brain Glutamine Synthesis Requires Neuronal-Born Aspartate as Amino Donor for Glial Glutamate Formation
Beatriz Pardo et al.