Telómeros en cáncer y regeneración
Resumen de Investigación:
Telómeros en cáncer y regeneración. Los telómeros son componentes esenciales de nuestro genoma ya que lo protegen de su deterioro y mantienen su estabilidad. Las fusiones teloméricas ocurren cuando dos cromosomas se unen físicamente a través de sus extremos. Las fusiones teloméricas pueden desencadenar una serie de reordenamientos genómicos y alteraciones oncogénicas que, en última instancia, conducen al desarrollo de tumores malignos y a la resistencia a la quimioterapia. A pesar de su relevancia en la evolución tumoral, nuestra comprensión de los patrones y consecuencias de las fusiones teloméricas en el cáncer humano sigue siendo limitada. Nuestro grupo está interesado en comprender la función de las fusiones teloméricas en cáncer y regeneración.
Fusiones teloméricas (FT) en cáncer. En los últimos años hemos caracterizado las tasas y el espectro de las FT somáticas en más de 30 tipos de cáncer. Hemos descubierto que las FT están muy extendidas en los tumores humanos, con tasas que varían enormemente entre y dentro de los distintos tipos de cáncer. Además de FT de extremo a extremo, hemos identificado patrones únicos relacionados con la vía alternativa de alargamiento de los telómeros (ALT). Un descubrimiento especialmente interesante ha sido la detección de FT en la sangre de pacientes con cáncer, lo que ofrece un método potencial para la detección precoz del cáncer con alta especificidad y sensibilidad. Esto es especialmente prometedor para tipos de cáncer como el de páncreas y los tumores cerebrales, que actualmente cuentan con opciones limitadas para su detección precoz. Mediante técnicas bioquímicas, moleculares, CRISPR/Cas y genómicas (NGS), seguiremos investigando la aparición y la función de FT en diversos tumores humanos y de ratón. Comprender el papel de las FT será crucial para desarrollar terapias dirigidas en pacientes con cáncer.
Fusiones teloméricas (TF) en la maduración de los cardiomiocitos y en regeneración cardiaca. La maduración en muchas células de mamíferos, incluidos los cardiomiocitos, va acompañada de un aumento del número de cromosomas, o poliploidización. Dado que las células poliploides no logran dividirse en la mayoría de los casos, la aparición de la poliploidía puede explicar por qué los cardiomiocitos no proliferan lo suficiente para regenerar el corazón después de un infarto. A pesar de su importancia, el mecanismo de poliploidización en cardiomiocitos sigue sin estar bien definido. En los últimos años, utilizando imágenes de alto contenido, hemos descubierto que aproximadamente la mitad de los cardiomiocitos postnatales de ratón que entran en mitosis tienen puentes cromosómicos discernibles. Además, observamos que la ploidía de los cardiomiocitos coincide con un número creciente de FTs lo que sugiere una ruta directa a la poliploidización. FTs están presentes en los corazones de ratones, peces cebra, cerdos y humanos. Los corazones de pez cebra tienen relativamente pocas FTs, lo que correlaciona con que que sus cardiomiocitos son mayoritariamente diploides y su alta capacidad regenerativa. La eliminación de la telomerasa inhibe la respuesta regenerativa y aumenta el número de cardiomiocitos poliploides, lo que respalda la idea de que la poliploidización de los cardiomiocitos afecta a la regeneración del corazón. En conjunto, estos resultados identifican a las FT como un mecanismo que conduce a la formación de puentes cromosómicos y a la poliploidización, y sugieren que la citocinesis fallida de los cardiomiocitos se origina a partir de un defecto mitótico. Actualmente estamos investigando si una regulación precisa de la telomerasa evita la presencia de FTs, aumenta el número de cardiomiocitos diploides y amplía la ventana de regeneración cardiaca.
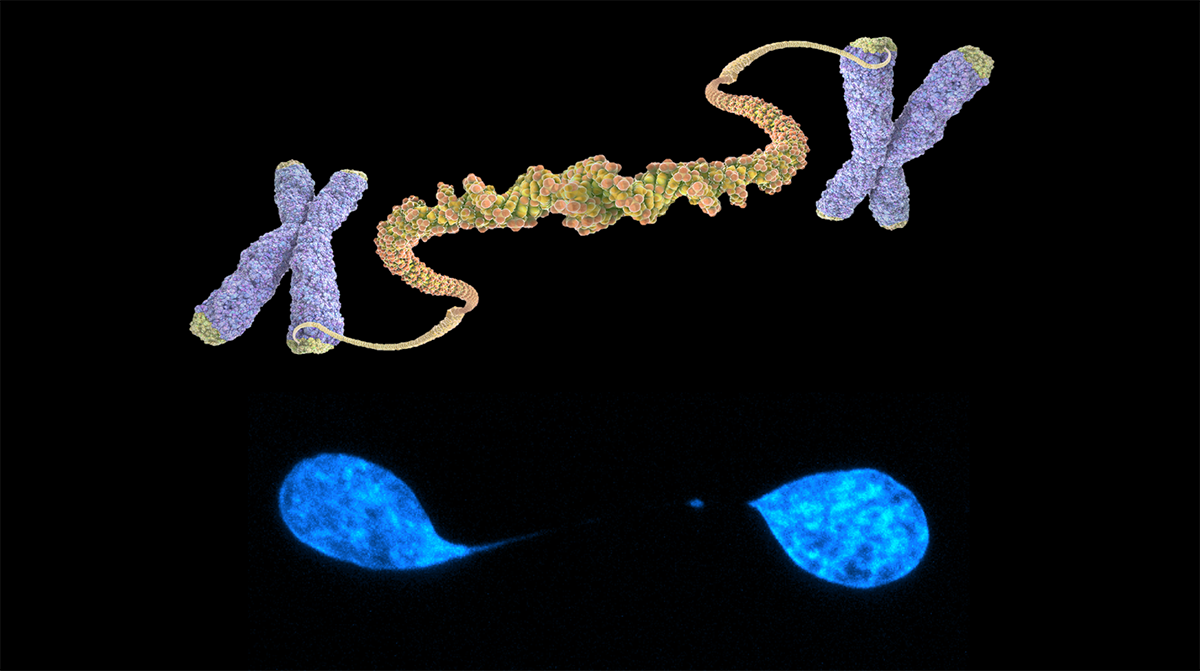
Fig. 1. Representación de una fusión telomérica (arriba) y tinción con DAPI de un puente de cromatina en una célula U2OS (abajo)

| Apellidos | Nombre | Laboratorio | Ext.* | Categoría profesional | |
|---|---|---|---|---|---|
| Arévalo Morales | Matilde | 403 | 4608 | Estudiante TFG | |
| Badarau | Ana María Andreea | 227 | 4608 | andreea.b(at)cbm.csic.es | M1 |
| Flores Hernández | Ignacio | 114.2 | 4581 | iflores(at)cbm.csic.es | Investigador Distinguido |
| Morillo Chincoa | María José | 114.2 | 4581 | maria.morillo(at)cbm.csic.es | M2 |
Publicaciones relevantes:
- Aix E, Gallinat A, Yago-Díez C, Lucas J, Gómez MJ, Benguría A, Freitag P, Cortez-Toledo E, Fernández de Manuel L, García-Cuasimodo L, Sánchez-Iranzo H, Montoya MC, Dopazo A, Sánchez-Cabo F, Mercader N, López JE, Fleischmann BK, Hesse M, Flores I. Telomeres Fuse During Cardiomyocyte Maturation. Circulation. 2023 May 23;147(21):1634-1636.
- González-Estévez C, Flores I. Fasting for stem cell rejuvenation. Aging. 2020 Mar 6;12(5):4048-4049.
- Marín-Aguilar F, Lechuga-Vieco AV, Cañadas-Lozano D, Alcocer-Gómez E, Castejón-Vega B, Lucas J, Garrido C, Peralta-Garcia A, Pérez-Pulido AJ, Varela-López A, Quiles JL, Ryffel B, Flores I, Bullón P, Ruiz-Cabello J, Cordero MD. NLRP3 inflammasome suppression improves longevity and prevents cardiac aging in male mice. Aging Cell. 2020 Jan;19(1):e13050.
- Iglesias M, Felix DA, Gutiérrez-Gutiérrez Ó, De Miguel-Bonet MDM, Sahu S, Fernández-Varas B, Perona R, Aboobaker AA, Flores I*, González-Estévez C*. Downregulation of mTOR Signaling Increases Stem Cell Population Telomere Length during Starvation of Immortal Planarians. Stem Cell Reports. 2019;13(2):405-418. (*Co-corresponding authors)
- Aix E, Gallinat A, Flores I. Telomeres and telomerase in heart regeneration. Differentiation. 2018; 100:26-30.
- Aguado T, Gutiérrez FJ, Aix E, Schneider RP, Giovannazo G, Blasco MA, Flores I. Telomere length defines the cardiomyocyte differentiation potency of mouse induced pluripotent stem cells. Stem Cells. 2017; 35(2):362-37
- Latorre-Pellicer A, Moreno-Loshuertos R, Lechuga-Vieco AV, Sánchez-Cabo F, Torroja C, Acín-Pérez R, Calvo E, Aix E, González-Guerra A, Logan A, Bernad-Miana ML, Romanos E, Cruz R, Carracedo A, Pérez-Martos A, Fernández-Silva P, Ruíz-Cabello J, Murphy M, Flores I, Vázquez J, Enríquez JA. Mismatch between mtDNA and nuclear DNA determines metabolism and healthy ageing. Nature. 2016; 535(7613):561-5.
- Aix E, Gutiérrez-Gutiérrez O and Flores I. Postnatal telomere dysfunction induces postnatal cardiomyocyte cell-cycle arrest through p21 activation. J Cell Biol. 2016; 6; 213(5):571-83. Editor´s choice “In Focus” section PMC4896062.
- Fernández-Alvira JM, Fuster V, Dorado B, Soberón N, Flores I, Gallardo M, Pocock S, Blasco MA and Andrés V. Short telomere load, telomere length and subclinical atherosclerosis in the PESA study. J Am Coll Cardiol. 2016; 67(21):2467-76.
- Bednarek D, González-Rosa JM, Guzmán-Martínez G, Gutiérrez-Gutiérrez Ó, Aguado T, Sánchez-Ferrer C, Marques IJ, Galardi-Castilla M, de Diego I, Gómez MJ, Cortés A, Zapata A, Jiménez-Borreguero LJ, Mercader N, Flores I. Telomerase Is Essential for Zebrafish Heart Regeneration. Cell Rep. 2015; 12(10):1691-703.
- Schneider RP, Garrobo I, Foronda M, Palacios JA, Marión RM, Flores I, Ortega S, Blasco MA. TRF1 is a stem cell marker and is essential for the generation of induced pluripotent stem cells. Nat Commun. 2013; 4:1946.
- Flores I, Blasco MA. Role of telomeres and telomerase in stem cell aging. FEBS Lett. 2010; 584 (17):3826-30. Review.
- Flores I, Blasco MA. A p53-dependent response limits epidermal stem cell functionality and organismal size in mice with short telomeres. PLoS One. 2009; 4(3):e4934.
- Ferrón SR, Marqués-Torrejón MA, Mira H, Flores I, Taylor K, Blasco MA, Fariñas I. Telomere shortening in neural stem cells disrupts neuronal differentiation and neuritogenesis. J Neurosci. 2009; 29(46):14394-407.
- Garcia-Lavandeira M, Quereda V, Flores I, Saez C, Diaz-Rodriguez E, Japon MA, Ryan AK, Blasco MA, Dieguez C, Malumbres M, Alvarez CV. A GRFa2/Prop1/stem (GPS) cell niche in the pituitary. PLoS One. 2009; 4(3):e4815.
- Tomás-Loba A*, Flores I*, Fernández-Marcos PJ, Cayuela ML, Maraver A, Tejera A, Borrás C, Matheu A, Klatt P, Flores JM, Viña J, Serrano M, Blasco MA.Telomerase reverse transcriptase delays aging in cancer-resistant mice. Cell. 2008; 135(4):609-22. (* These authors contributed equally to this work)
- Espada J, Varela I, Flores I, Ugalde AP, Cadiñanos J, Pendás AM, Stewart CL, Tryggvason K, Blasco MA, Freije JM, López-Otín C. Nuclear envelope defects cause stem cell dysfunction in premature-aging mice. J Cell Biol. 2008; 181(1):27-35.
- Flores I, Canela A, Vera E, Tejera A, Cotsarelis G, Blasco MA. The longest telomeres: a general signature of adult stem cell compartments. Genes Dev. 2008; 22(5):654-67.
- Siegl-Cachedenier I, Flores I, Klatt P, Blasco MA.Telomerase reverses epidermal hair follicle stem cell defects and loss of long-term survival associated with critically short telomeres. J Cell Biol. 2007; 179(2):277-90.
- Matheu A, Maraver A, Klatt P, Flores I, Garcia-Cao I, Borras C, Flores JM, Viña J, Blasco MA, Serrano M. Delayed ageing through damage protection by the Arf/p53 pathway. Nature. 2007; 448(7151):375-9.
- Flores I, Evan G, Blasco MA. Genetic analysis of myc and telomerase interactions in vivo. Mol Cell Biol. 2006; 26(16):6130-8.
- Flores I, Benetti R, Blasco MA. Telomerase regulation and stem cell behaviour. Curr Opin Cell Biol. 2006; 18(3):254-60. Review.
- Flores I, Cayuela ML, Blasco MA. Effects of telomerase and telomere length on epidermal stem cell behavior. Science. 2005; 309(5738):1253-6.
- Under review:
- Francesc Muyas, Manuel José Gómez Rodriguez, Isidro Cortes-Ciriano, Ignacio Flores.The ALT pathway generates telomere fusions that can be detected in the blood of cancer patients. bioRxiv 2022.01.25.477771; doi: https://doi.org/10.1101/2022.01.25.477771
- Marielle Breau, Christelle Cayrou, Dmitri Churikov, Charles Fouillade, Sandra Curras-Alonso, Serge Bauwens, Frederic Jourquin, Laura Braud, Frederic Fiore, Rémy Castellao, Emmanuelle Josselin, Carlota SánchezFerrer, Giovanna Giovinazzo, Eric Gilson, Ignacio Flores, Arturo Londono-Vallejo, Serge Adnot, Vincent Géli. Telomerase Prevents Emphysema in Old Mice by Sustaining Subpopulations of Endothelial and AT2 Cells. bioRxiv 2021.01.07.425708; doi: https://doi.org/10.1101/2021.01.07.425708




















