Mecanismos de plasticidad sináptica y contribución a la función cognitiva
Resumen de Investigación:
Un aspecto fundamental de la biología de las neuronas es la plasticidad sináptica. Las conexiones sinápticas entre neuronas son altamente dinámicas. Este continuo remodelado de las sinapsis es crítico para el establecimiento y la maduración de los circuitos neuronales en el cerebro, y además para la memoria y el aprendizaje. Por otra parte, múltiples enfermedades neurológicas (como la esquizofrenia, varias formas de retraso mental o la enfermedad de Alzheimer) se han correlacionado con defectos en la plasticidad sináptica. La investigación en el laboratorio está centrada en los procesos moleculares y celulares responsables de la plasticidad sináptica. De esta forma pretendemos entender cuáles son los mecanismos básicos subyacentes en el desarrollo cerebral, aprendizaje y memoria.
Investigaciones recientes en varios laboratorios, incluido el nuestro, han determinado que el transporte de receptores de neurotransmisor en las sinapsis es un componente fundamental de la plasticidad sináptica. En concreto, nuestro grupo de investigación ha realizado estudios pioneros sobre la regulación de la inserción e internalización de receptores de glutamato en las sinapsis del hipocampo. El trabajo en el laboratorio se organiza en torno a tres líneas fundamentales:
1) Identificación de las cascadas de señalización celular que median el transporte de receptores y su inserción en las sinapsis.
2) Identificación de la maquinaria celular que dirige el movimiento y la direccionalidad del transporte en las sinapsis.
3) Análisis de posibles alteraciones en los mecanismos de plasticidad sin áptica asociadas a enfermedades cognitivas.
Una aproximación experimental fundamental en el laboratorio es la expresión de receptores recombinantes y proteínas reguladoras marcadas con GFP en secciones de hipocampo, utilizando técnicas de electrofisiología e “imaging” como ensayos funcionales. El laboratorio cuenta con una fuerte vocación multidisciplinar, que consideramos es esencial para entender cómo moléculas individuales contribuyen al funcionamiento de las neuronas en el cerebro.
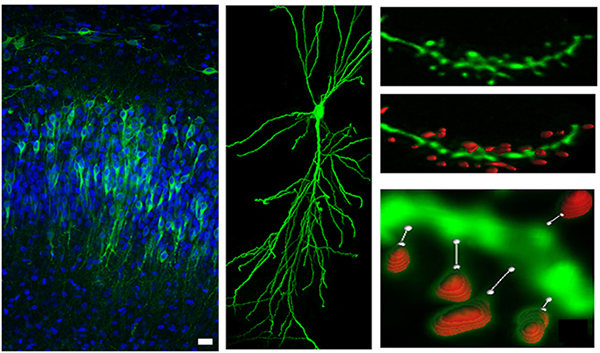
Figura 1.
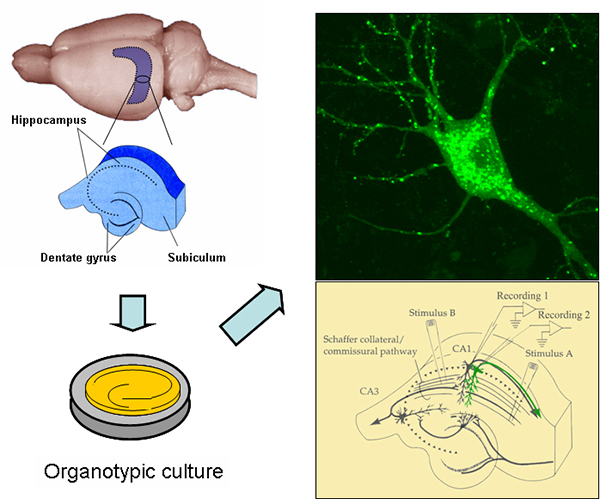
Figura 2.

Figura 3.
| Apellidos | Nombre | Laboratorio | Ext.* | Categoría profesional | |
|---|---|---|---|---|---|
| Esteban García | José Antonio | 303 | 4637 | jaesteban(at)cbm.csic.es | E. Profesores de Investigación de Organismos Públicos de Investigación |
| Fernández Rodrigo | Alba | 303 | 4657 | alba.fernandez(at)cbm.csic.es | M2 66,66% |
| García Vilela | Celia | 303 | 4657 | celia.garcia(at)cbm.csic.es | Titulado Sup. Actividades Tecn. y Prof.GP1 |
| Gutiérrez Eisman | Silvia | 303 | 4657 | sgeisman(at)cbm.csic.es | E.Ayudantes De Invest. De Los Oo.Publicos De Investigacion |
| López Merino | Esperanza Isabel | 303 | 4657 | elopez(at)cbm.csic.es | M2 66,66% |
| Maroto Martínez | Irene Berenice | 303 | 4637 | imaroto(at)cbm.csic.es | Doctor FC3 |
Publicaciones relevantes:
- Brachet A, Lario A, Fernández-Rodrigo A, Heisler FF, Gutiérrez Y, Lobo C, Kneussel M, Esteban JA. A kinesin 1-protrudin complex mediates AMPA receptor synaptic removal during long-term depression. Cell Rep 36:109499, 2021.
- Gutiérrez Y, López-García S, Lario A, Gutiérrez-Eisman S, Delevoye C, Esteban JA. KIF13A drives AMPA receptor synaptic delivery for long-term potentiation via endosomal remodeling. J Cell Biol 220:e202003183, 2021.
- Draffin JE, Sánchez-Castillo C, Fernández-Rodrigo A, Sánchez-Sáez X, Ávila J, Wagner FF, Esteban JA. GSK3α, not GSK3β, drives hippocampal NMDAR-dependent LTD via tau-mediated spine anchoring. EMBO J 40:e105513, 2021.
-
Navarrete M, Cuartero MI, Palenzuela R, Draffin JE, Konomi A, Serra I, Colié S, Castaño-Castaño S, Hasan MT, Nebreda AR, Esteban JA. Astrocytic p38α MAPK drives NMDA receptor-dependent long-term depression and modulates long-term memory. Nat Commun 10(1):2968, 2019.


- Sánchez-Puelles C, Calleja-Felipe M, Ouro A, Bougamra G, Arroyo A, Díez I, Erramuzpe A, Cortés J, Martínez-Hernández J, Luján R, Navarrete M, Venero C, Chan A, Morales M, Esteban JA*, Knafo S*. PTEN activity defines an axis for plasticity at cortico-amygdala synapses and influences social behavior. Cereb Cortex, doi: 10.1093/cercor/bhz103, 2019.
- Palenzulea R, Gutiérrez Y, Draffin J, Lario A, Benoist M, Esteban JA. MAP1B light chain modulates synaptic transmission via AMPA receptor intracellular trapping. J Neurosci 37, 9945-9963, 2017.
- Knafo S, Esteban JA. PTEN: local and global modulation of neuronal function in health and disease. Trends Neurosci 40, 22-30, 2017.
- Knafo S, Sánchez-Puelles C, Palomer E, Delgado I, Draffin JE, Mingo J, Wahle T, Kaleka K, Mou L, Pereda-Perez I, Klosi E, Faber EB, Champan HM, Lozano-Montes L, Ortega-Molina A, Ordóñez-Gutiérrez L, Wandosell F, Viña J, Dotti CG, Hall RA, Pulido R, Gerges NZ, Chan AM, Spaller MR, Serrano M, Venero C, Esteban JA. PTEN recruitment controls synaptic and cognitive function in Alzheimer's models. Nat Neurosci 19, 443-453, 2016.
Science Signaling ¦ EDITORS' CHOICE - Brachet A, Norwood S, Brouwers JF, Palomer E, Helms JB, Dotti CG, Esteban JA. LTP-triggered cholesterol redistribution activates Cdc42 and drives AMPA receptor synaptic delivery. J Cell Biol 208, 791-806, 2015.
- Benoist M, Palenzuela R, Rozas C, Rojas P, Tortosa E, Morales B, González-Billault C, Avila J, Esteban JA. MAP1B-dependent Rac activation is required for AMPA receptor endocytosis during long-term depression. EMBOJ 32:2287-2299, 2013.
- Fernández-Monreal M, Brown TC, Royo M, Esteban JA. The balance between receptor recycling and trafficking toward lysosomes determines synaptic strength during long-term depression. J Neurosci 32:13200-13205, 2012.
- Knafo S, Venero C, Sánchez-Puelles C, Pereda-Peréz I, Franco A, Sandi C, Suárez LM, Solís JM, Alonso-Nanclares L, Martín ED, Merino-Serrais P, Borcel E, Li S, Chen Y, Gonzalez-Soriano J, Berezin V, Bock E, DeFelipe J, Esteban JA. Facilitation of AMPA receptor synaptic delivery as a molecular mechanism for cognitive enhancement. PLoS Biology 10, doi:10.1371/journal.pbio.1001262, 2012.
NATURE | RESEARCH HIGHLIGHTS
- Jurado S, Benoist M, Lario A, Knafo S, Petrok CN and Esteban JA. PTEN is recruited to the postsynaptic terminal for NMDA receptor-dependent long-term depression. EMBOJ 29:2827-2840, 2010.
- Arendt KL, Royo M, Férnandez-Monreal M, Knafo S, Petrok CN, Martens JR and Esteban JA. PIP3 controls synaptic function by maintaining AMPA receptor clustering at the postsynaptic membrane. Nat Neurosci 13:36-44, 2010.





















