Mecanismos patogénicos de la enfermedad de Alzheimer
Resumen de Investigación:
Para identificar genes y mecanismos involucrados en la neurodegeneración característica de la enfermedad de Alzheimer (EA), desarrollamos modelos celulares que reflejan diferentes aspectos de la patogénesis de la enfermedad. Estos modelos nos permiten la identificación de nuevos genes/funciones asociados con la EA, que podrían ser dianas terapéuticas para la misma. Para ello, analizamos la expresión génica diferencial en los modelos y desarrollamos estudios de asociación genética y biomarcadores en muestras clínicas. En los últimos años nos hemos centrado en modelos de infección por el virus herpes simplex 1 (HSV-1) que presentan marcadores característicos de la EA, entre los que destacan alteraciones en el tráfico, metabolismo y proteolisis de la proteína precursora de amiloide (APP), así como en la fosforilación de la proteína tau.
El estudio de la vía autofagia lisosoma en estos modelos nos ha mostrado que HSV 1, sobre todo en presencia de estrés oxidativo, afecta profundamente a las etapas finales de la ruta, provocando un aumento del contenido lisosomal acompañado de una reducción significativa en la actividad de diferentes catepsinas y en la degradación de sustratos lisosomales. La comprobación de que otro alfa-herpesvirus con propiedades neurotrópicas, el HSV-2, induce los mismos marcadores de neurodegeneración que HSV-1, apoya la posible implicación de diversos agentes infecciosos en la neurodegeneración asociada a la EA.
Los resultados de los estudios funcionales y de asociación genética / biomarcadores apoyan la hipótesis de que el fallo de la función lisosomal podría constituir un mecanismo relevante en la neurodegeneración inducida por HSV-1 y, en general, en la neurodegeneración de tipo EA, por lo que nuestro grupo está centrado en el estudio de esta ruta funcional. Actualmente, estamos desarrollando modelos celulares más complejos, a partir de NPCs humanas, para validar nuestros hallazgos previos en un entorno más fisiológico y profundizar en los mecanismos implicados.
Además, participamos en diversos proyectos colaborativos. Los más numerosos son los dirigidos al estudio de la arquitectura genética de la EA, en el marco del Consorcio Español de Genética de las Demencias (DEGESCO) y de los consorcios internacionales EADB e IGAP, que continúan revelando nuevos factores y funciones relevantes en la patogénesis de esta enfermedad.
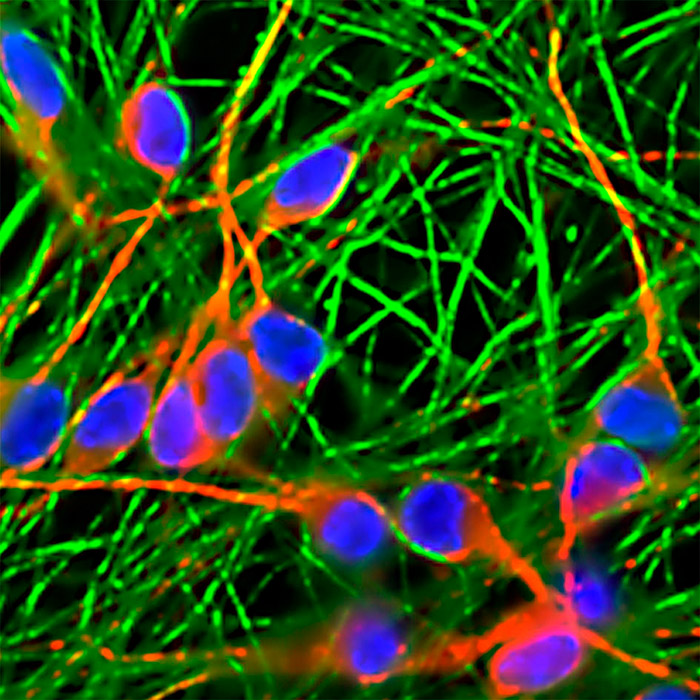
Neuronas LUHMES a día 7 de diferenciación, marcadas con anticuerpos específicos para MAP2 (rojo) y B-III tubulina (verde). Se muestran también los núcleos marcados con DAPI.

| Apellidos | Nombre | Laboratorio | Ext.* | Categoría profesional | |
|---|---|---|---|---|---|
| Aldudo Soto | Jesús | 410 | 4674 | jaldudo(at)cbm.csic.es | Contratado Doctor CIBER |
| Bullido Gómez-Heras | Mª Jesús | 410 | 4567/ 4674 | mjbullido(at)cbm.csic.es | Profesor Titular Universidad, GA |
| Martín Rico | María | 410 | 4674 | maria.martin(at)cbm.csic.es | Titulado Sup.Inv.y Laboratorio |
| Recuero Vicente | María | 410 | 4674 | mrecuero(at)cbm.csic.es | Contratado Doctor CIBER |
| Salgado Fuentes | Blanca | 410 | 4674 | bsalgado(at)cbm.csic.es | Contrato Predoctoral |
Publicaciones relevantes:
-
Herpes Simplex Virus Type 1 Induces AD-like Neurodegeneration Markers in Human Progenitor and Differentiated ReNcell VM Cells. Salgado B, Sastre I, Bullido MJ, Aldudo J. Microorganisms. 2023 May 4;11(5):1205. doi: 10.3390/microorganisms11051205. PMID: 37317179 Free PMC article.
-
Metabolic Overlap between Alzheimer's Disease and Metabolic Syndrome Identifies the PVRL2 Gene as a New Modulator of Diabetic Dyslipidemia. Guardiola M, Muntané G, Martínez I, Martorell L, Girona J, Ibarretxe D, Plana N, Bullido MJ, Vilella E, Ribalta J. Int J Mol Sci. 2023 Apr 18;24(8):7415. doi: 10.3390/ijms24087415. PMID: 37108578 Free PMC article.
-
Cholesterol dysregulation in peripheral blood mononuclear cells of Alzheimer's disease. Martín-Montes A, Recuero M, Sastre I, Vilella E, Rosich-Estragó M, Atienza M, Cantero JL, Frank-García A, Bullido MJ. J Neuroimmunol. 2022 Dec 15;373:577996. doi: 10.1016/j.jneuroim.2022.577996. Epub 2022 Oct 28. PMID: 36334319
-
New insights into the genetic etiology of Alzheimer's disease and related dementias. Bellenguez C, Küçükali F, Jansen IE, Kleineidam L, Moreno-Grau S, Amin N, Naj AC, et al Nat Genet. 2022 Apr;54(4):412-436. doi: 10.1038/s41588-022-01024-z. Epub 2022 Apr 4. PMID: 35379992 Free PMC article.
-
Matrix metalloproteinase 14 regulates HSV-1 infection in neuroblastoma cells. Llorente P, Mejías V, Sastre I, Recuero M, Aldudo J, Bullido MJ. Antiviral Res. 2021 Aug;192:105116. doi: 10.1016/j.antiviral.2021.105116. Epub 2021 Jun 6. PMID: 34107282
-
Common variants in Alzheimer's disease and risk stratification by polygenic risk scores. de Rojas I, Moreno-Grau S, Tesi N, Grenier-Boley B, Andrade V, Jansen IE, Pedersen NL, et al Nat Commun. 2021 Jun 7;12(1):3417. doi: 10.1038/s41467-021-22491-8. PMID: 34099642 Free PMC article.
-
LAMP2 deficiency attenuates the neurodegeneration markers induced by HSV-1 infection. Kristen H, Sastre I, Aljama S, Fuentes M, Recuero M, Frank-García A, Martin A, Sanchez-Juan P, Lage C, Bullido MJ, Aldudo J. Neurochem Int. 2021 Jun;146:105032. doi: 10.1016/j.neuint.2021.105032. Epub 2021 Mar 27. PMID: 33781848
-
Matrix Metalloproteinase 14 Mediates APP Proteolysis and Lysosomal Alterations Induced by Oxidative Stress in Human Neuronal Cells. Llorente P, Martins S, Sastre I, Aldudo J, Recuero M, Adjaye J, Bullido MJ. Oxid Med Cell Longev. 2020 Nov 16;2020:5917187. doi: 10.1155/2020/5917187. eCollection 2020. PMID: 33282112 Free PMC article.
-
Genetic meta-analysis of diagnosed Alzheimer's disease identifies new risk loci and implicates Aβ, tau, immunity and lipid processing. Kunkle BW, Grenier-Boley B, Sims R, Bis JC, Damotte V, Naj AC, Boland A, et al. Nat Genet. 2019 Mar;51(3):414-430. doi: 10.1038/s41588-019-0358-2. Epub 2019 Feb 28. PMID: 30820047 Free PMC article.
-
The lysosome system is severely impaired in a cellular model of neurodegeneration induced by HSV-1 and oxidative stress. Kristen H, Sastre I, Muñoz-Galdeano T, Recuero M, Aldudo J, Bullido MJ. Neurobiol Aging. 2018 Aug;68:5-17. doi: 10.1016/j.neurobiolaging.2018.03.025. Epub 2018 Mar 29. PMID: 29689425
-
A Free Radical-Generating System Regulates Amyloid Oligomers: Involvement of Cathepsin B. Llorente P, Kristen H, Sastre I, Toledano-Zaragoza A, Aldudo J, Recuero M, Bullido MJ. J Alzheimers Dis. 2018;66(4):1397-1408. doi: 10.3233/JAD-170159. PMID: 30400084
-
Microbes and Alzheimer's Disease. Itzhaki RF, Lathe R, Balin BJ, Ball MJ, Bearer EL, Braak H, Bullido MJ, et al. J Alzheimers Dis. 2016;51(4):979-84. doi: 10.3233/JAD-160152. PMID: 26967229 Free PMC article. Review. No abstract available.
-
Herpes simplex virus type I induces an incomplete autophagic response in human neuroblastoma cells. Santana S, Bullido MJ, Recuero M, Valdivieso F, Aldudo J. J Alzheimers Dis. 2012;30(4):815-31. doi: 10.3233/JAD-2012-112000. PMID: 22475795
Premios:
- Fundación Madrid+D. Premio a las mejores patentes; accésit. (2011)
- Sociedad Madrileña de Neurología. Premio Ramón y Cajal de Investigación básica (2011)




















