Fisiopatología molecular de la fibrosis
Resumen de Investigación:
La fibrosis de los órganos es un resultado final común de muchas enfermedades como la nefropatía diabética, la cirrosis hepática, la esclerodermia o la esclerosis miocárdica. Implica la sustitución de tejido vivo celular por matriz extracelular, con el consiguiente trastorno funcional. Por tanto, es fundamental comprender las vías moleculares subyacentes que conducen a la fibrogénesis en la patología humana. Los microRNAs son reguladores postranscripcionales esenciales de la expresión génica para múltiples vías fisiológicas y fisiopatológicas, incluida la fibrosis. Durante los últimos años nos hemos centrado en la fibrosis renal en dos cuestiones: a) el papel del metabolismo en la génesis de la lesión y reparación renal y b) el papel de los miRNAs implicados en vías metabólicas específicas críticas para la función de las células epiteliales tubulares. Nuestro objetivo es prevenir, aplazar o revertir la fibrosis en el riñón mediante la comprensión de los cambios metabólicos subyacentes asociados con la fibrosis renal. Para ello utilizamos modelos animales con ganancia de función específica para enzimas críticas implicadas en la oxidación de ácidos grasos, como la carnitina palmitoiltransferasa 1A (CPT1A). Estos estudios se complementan con modelos celulares y enfoques bioquímicos dirigidos al estudio de la biogénesis y función mitocondrial. Hemos descubierto que la sobreexpresión de la enzima Cpt1a en los túbulos renales promueve una oxidación mejorada de los ácidos grasos, restaura la homeostasis mitocondrial y protege de la fibrosis. Además, hemos identificado microARN específicos que son importantes para regular la génesis de la fibrosis al dirigirse a rutas metabólicas específicas.
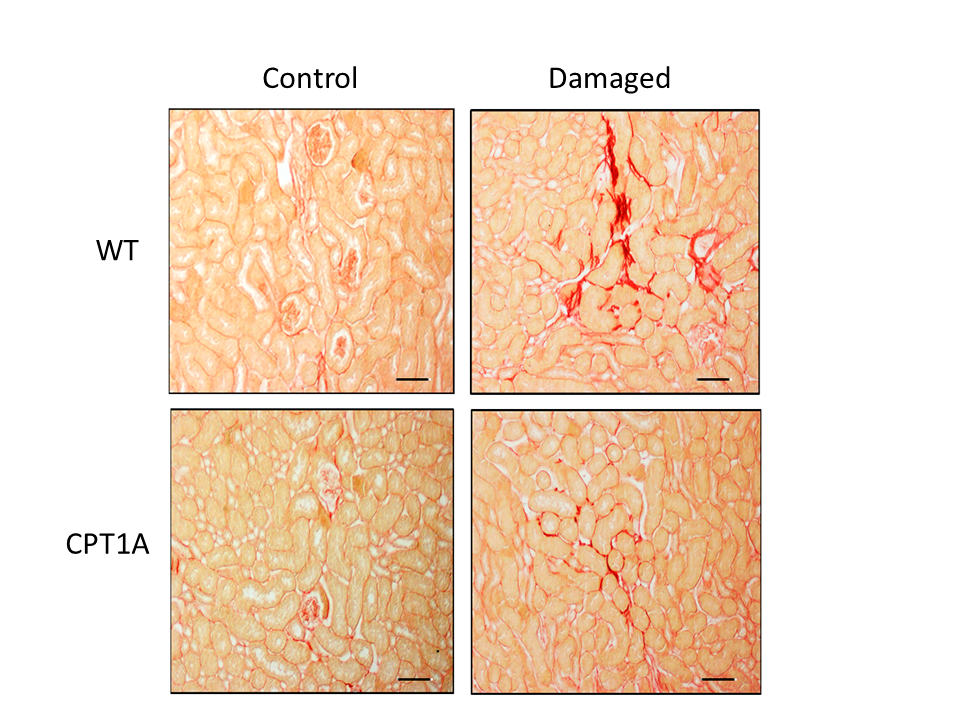
Figura 1: Modelo animal de fibrosis renal. Tinción de colágeno con rojo sirius de riñones de ratones que sobreexpresan Cpt1a en un modelo animal de fibrosis experimental. La intensidad del color rojo refleja el grado de fibrosis.
* Editor asociado de la revista Redox Biology http://www.journals.elsevier.com/redox-biology/

| Apellidos | Nombre | Laboratorio | Ext.* | Categoría profesional | |
|---|---|---|---|---|---|
| Lamas Peláez | Santiago | 103 | 4455 | slamas(at)cbm.csic.es | E. Profesores de Investigación de Organismos Públicos de Investigación |
| Pinto Díez | Celia | 103 | 4456 | celia.pinto(at)cbm.csic.es | M3 |
| Sirera Conca | Belén | 103 | 4456 | bsirera(at)cbm.csic.es | Titulado Sup. Actividades Tecn. y Prof.GP1 |
| Tituaña Fajardo | Jessica Paola | 103 | 4456 | jtituana(at)cbm.csic.es | M2 |
Publicaciones relevantes:
- Miguel V, Tituaña J, Herrero JI, Herrero L, Serra D, Cuevas P, Barbas C, Rodríguez-Puyol D, Márquez-Exposito L, Ruiz-Ortega M, Castillo C, Sheng X, Susztak K, Ruiz-Canela M, Salas-Salvadó J, Hu FB, Martínez Gonzalez MA, Ortega S, Ramos R, Lamas S. (2021). Renal tubule Cpt1a overexpression mitigates kidney fibrosis by restoring mitochondrial homeostasis. Journal of Clinical Investigation. 131(5):e140695.
- Miguel V, Ramos R, García-Bermejo L, Rodríguez-Puyol D, Lamas S. (2020). The program of renal fibrogenesis is controlled by microRNAs regulating oxidative metabolism. Redox Biology. 40: 101851.
- Ruiz-Ortega M, Rayego-Mateos S, Lamas S, Ortiz A, Rodrigues-Díez R. (2020). Targeting the progression of chronic kidney disease. Nature Reviews Nephrology. 16, (5):269-288.
- Price NL*, Miguel V*, Ding W, Singh AK, Malik S, Rotllan N, Moshnikova A, Toczek J, Zeiss C, Sadeghi M, Arias Rueda N, Baldán A, Andreev O, Rodriguez-Puyol D, Bahal R, Reshetnyak YK, Suárez Y, Fernández-Hernando C, Lamas S. (2019). Genetic deficiency and pharmacological inhibition of miR-33 enhances renal fatty acid oxidation and attenuates kidney fibrosis. JCI Insight. 4 (22): e131102.
- Fierro-Fernández M, Miguel V, Márquez-Expósito L, Nuevo-Tapioles C, Herrero JI, Blanco-Ruiz E, Tituaña J, Castillo C, Cannata P, Monsalve M, Ruiz-Ortega M, Ramos R, Lamas S. (2020). MiR-9-5p protects from kidney fibrosis by metabolic reprogramming. FASEB Journal. 34(1):410-431.
- Miguel V, Lamas S. (2019) Redox Distress in Organ Fibrosis: The Role of Non-Coding RNAs. Oxidative Stress: Eustress and Distress. Role in Health and Disease Processes. Helmut Sies (Ed.) Elsevier. 37:779-820.
- Espinosa-Díez C, Miguel V, Vallejo S, Sánchez FJ, Sandoval E, Blanco E, Cannata P, Peiró C, Sánchez-Ferrer CF, Lamas S. (2018). Role of glutathione biosynthesis in endothelial dysfunction and fibrosis. Redox Biol. 14:88-99.
- Miguel V, Busnadiego O, Fierro-Fernandez M, Lamas S. (2016). Protective role of miR-9-5p in the fibrogenic transformation of human dermal fibroblasts. Fibrogenesis and Tissue Repair. 9:7.
Tesis doctorales:
- Carlos Rey Serra. (2021). Impact of the circadian regulation on the metabolic basis of the kidney fibrosis. UAM. Director: Santiago Lamas.
- Verónica Miguel Herranz. (2019) The metabolic basis of renal fibrosis: Role of microRNAs and insight from genetic models targeting lipid metabolism. UAM. Director: Santiago Lamas. Mención internacional.
- M. Cristina Espinosa Diez. (2015). Papel de la g-glutamilcistein ligasa en modelos de daño vascular y fibrótico e implicación de miR-433 en la síntesis de glutation. Director: Santiago Lamas
- M. Ángeles Higueras López. (2014). Fisiología y Fisiopatología de DLK-1 en el Endotelio Vascular. Universidad Complutense de Madrid. Director: Santiago Lamas y Patricia Rodríguez
- Rosa Bretón Romero (2013). Redox Signaling Responses to Laminar Shear Stress in vascular endothelial cells. Universidad Autónoma de Madrid. Director: Santiago Lamas
- David Lagares Salto. (2012) Implicaciones Fisiopatológicas y Terapeuticas del eje TGF-beta/ET-1 y la Quinasa de Adhesión Focal en los procesos Fibróticos. UAM. Director: Santiago Lamas Peláez y Fernando Rodríguez Pascual.
Patentes:
- Solicitud Patente Europea "Compounds for prevention and/or treatment of fibrotic diseases" Application No/Patent No 14382239.3-1401
- Solicitud internacional de la patente 201031547 “Uso de Dlk1 como inhibidor de angiogénesis”, diciembre 2011.
Premios
- Doctor Honoris Causa por la Facultad de medicina por la Universidad de la republica de Montevideo. Mayo 2021.
- Premio de investigación en nefrología Iñigo Álvarez de Toledo. Dra. Verónica Miguel Herranz
Actividades I+D
- Moderador de la sesión “SIMPOSIO. Terapia celular en nefrología”, en el marco del 51 Congreso Virtual de la Sociedad Española de Nefrología, celebrado del 15 al 18 de octubre de 2021.
- Morador en The Training School 3 of ITN TREATMENT. “La base metabólica de la fibrosis renal”. 1 al 3 de julio de 2019.
- Moderador del Curso Lectivo EMBO-FEBS. "Mecanismos moleculares de la lesión, reparación y fibrosis tisular" 23 al 31 de mayo de 2019.
- Moderador in Keystone Symposia on Molecular and Cellular Biology. Role of MicroRNAs in the metabolic basis of renal fibrosis Role of MicroRNAs in the metabolic. 3-8 de marzo
- Workshop "Redox Biology as a major drive to the understanding of pathophysiology: Contributions from the CONSOLREDOX network". Salamanca. Abril 2018




















