Papel de la mitocondria en patología humana
Resumen de Investigación:
Las mitocondrias juegan un papel clave en el metabolismo celular, la bioenergética, la ejecución de la muerte y la señalización intracelular. De acuerdo con la relevancia fundamental de sus funciones fisiológicas, la disfunción mitocondrial está involucrada en la génesis y la progresión del envejecimiento y de una gran cantidad de patologías humanas, incluyendo el cáncer, la neurodegeneración, el síndrome metabólico y algunas enfermedades raras. La ATP sintasa mitocondrial es un transductor clave en la regulación metabólica y conservación de la energía por fosforilación oxidativa (OXPHOS), en la ejecución de la muerte celular y en la señalización intracelular mediada por especies reactivas de oxígeno (ROS). Anteriormente, hemos documentado los mecanismos y el papel que desempeña la ATP sintasa en la reprogramación metabólica durante el desarrollo del hígado y en los carcinomas humanos. Más recientemente, hemos demostrado que el inhibidor de la ATP sintasa, llamado Factor Inhibidor 1 de la ATPasa (IF1), está sobreexpresado en carcinomas, y que desempeña un papel fundamental en la reprogramación metabólica que acontece en las células tumorales, las células madre y en la oncogénesis hepática. Hemos demostrado que la unión de IF1 a la ATP sintasa inhibe la enzima en condiciones fisiológicas y que su unión se evita mediante la fosforilación de la S39 de IF1 mediada por una actividad mitocondrial similar a la proteína quinasa A dependiente de AMPc. La inhibición de la ATP sintasa por IF1 es necesaria para la adaptación a la hipoxia, la progresión del ciclo celular y en cáncer. Por el contrario, se requiere la desfosforilación de IF1 para aumentar la producción mitocondrial de ATP en respuesta a un aumento de la demanda energética en el corazón in vivo. Además, la inhibición de la ATP sintasa mediada por IF1, desencadena una señal de ROS que promueve la activación de programas nucleares de proliferación y resistencia a la muerte celular. Por lo tanto, IF1 es una proteína mitocondrial muy relevante que participa en la definición del fenotipo celular.
Un objetivo principal de nuestro grupo es profundizar en la caracterización de la biología celular y del papel que ejerce el módulo ATP sintasa / IF1 en el cáncer, la función neuronal, los trastornos metabólicos y el envejecimiento. Nuestra investigación tiene una clara orientación traslacional, por ser líderes de las unidades "713" del CIBER de Enfermedades Raras (CIBERER) y del "Metabolismo Energético Traslacional" del i + 12, dos iniciativas del "Instituto de Salud Carlos III". Para cubrir estos objetivos, hemos desarrollado ratones transgénicos (Tg-IF1) que sobreexpresan condicionalmente IF1 humano en neuronas, hígado, colon (Fig.1), corazón o músculo esquelético, y hemos generado el ratón ATP5IF1 lox/lox que hemos utilizado con éxito para eliminar IF1 (IF1-KO) en neuronas o en enterocitos. Con estos modelos de ratón hemos demostrado in vivo el papel de la ATP sintasa / IF1 en la reprogramación metabólica y en la señalización de respuestas celulares y tisulares adaptativas en situaciones normales y patológicas (Fig. 2). Además, hemos desarrollado la plataforma PROTEOmAb, basada en tecnología de "arrays de proteínas de fase inversa", para la identificación de nuevos biomarcadores de la patología humana. Estos estudios se combinan con el “screening” de pequeñas moléculas aprobadas por la FDA que modulan la OXPHOS. Predecimos que el enfoque combinado de estas dos estrategias proporcionará una traslación rápida y efectiva al paciente de nuevos medicamentos para el tratamiento de patologías y afecciones asociadas a la disfunción mitocondrial.
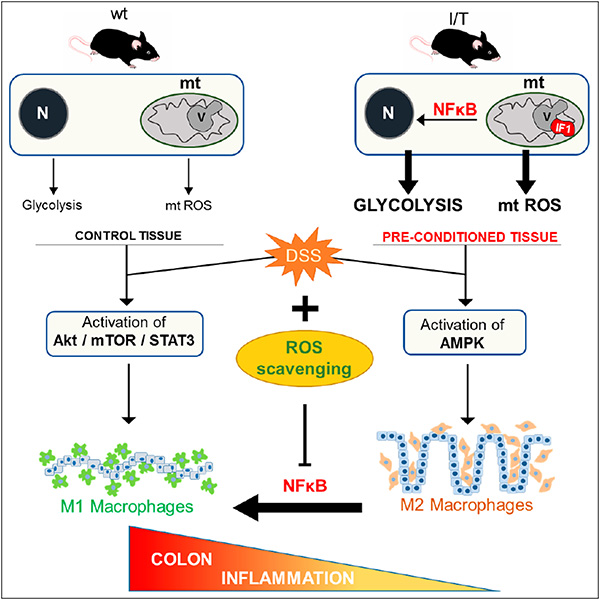
Fig.1: Papel de la señalización por ROS mitocondriales en la respuesta inmune del colon. Gráfico tomado de la referencia Cell Rep. 2017 May 9;19(6):1202-1213.
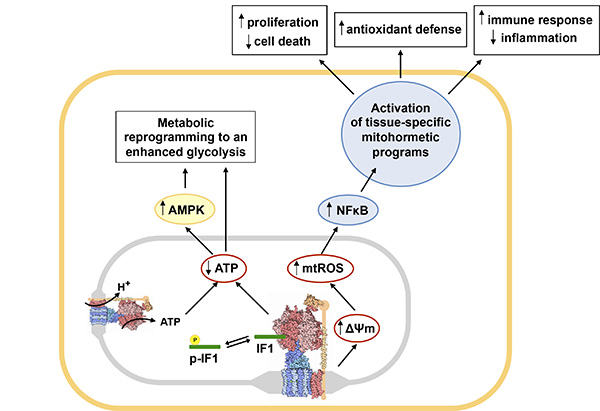
Fig. 2: Principales vías metabólicas y redox reguladas por inhibición de la ATP sintasa mediada por IF1 defosforilado. Figura tomada de la referencia Front Oncol. 2018 Mar 7;8:53.

| Apellidos | Nombre | Laboratorio | Ext.* | Categoría profesional | |
|---|---|---|---|---|---|
| Domínguez Zorita | Sonia | 326 | 4648 | sonia.dominguez(at)cbm.csic.es | Tit.Sup.Activ.Técn.y Profes. GP1 |
Publicaciones relevantes:
- González-Llorente L, Santacatterina F, García-Aguilar A, Nuevo-Tapioles C, González-García S, Tirpakova Z, Toribio ML, Cuezva JM. Overexpression of Mitochondrial IF1 Prevents Metastatic Disease of Colorectal Cancer by Enhancing Anoikis and Tumor Infiltration of NK Cells. Cancers (Basel). 2019 Dec 19;12(1). pii: E22. doi: 10.3390/cancers12010022
- Esparza-Moltó PB, Nuevo-Tapioles C, Chamorro M, Nájera L, Torresano L, Santacatterina F, Cuezva JM. Tissue-specific expression and post-transcriptional regulation of the ATPase inhibitory factor 1 (IF1) in human and mouse tissues. FASEB J. 2019 Feb;33(2):1836-1851. doi: 10.1096/fj.201800756R.
- Santacatterina F, Torresano L, Núñez-Salgado A, Esparza-Molto PB, Olive M, Gallardo E, García-Arumi E, Blazquez A, González-Quintana A, Martín MA, Cuezva JM. Different mitochondrial genetic defects exhibit the same protein signature of metabolism in skeletal muscle of PEO and MELAS patients: A role for oxidative stress. Free Radic Biol Med. 2018 Oct;126:235-248. doi: 10.1016/j.freeradbiomed.2018.08.020.
- Formentini L, Santacatterina F, Núñez de Arenas C, Stamatakis K, López-Martínez D, Logan A, Fresno M, Smits R, Murphy MP, Cuezva JM. Mitochondrial ROS Production Protects the Intestine from Inflammation through Functional M2 Macrophage Polarization. Cell Rep. 2017 May 9;19(6):1202-1213. doi: 10.1016/j.celrep.2017.04.036.
- Santacatterina F, Sánchez-Cenizo L, Formentini L, Mobasher MA, Casas E, Rueda CB, Martínez-Reyes I, Núñez de Arenas C, García-Bermúdez J, Zapata JM, Sánchez-Aragó M, Satrústegui J, Valverde ÁM, Cuezva JM. Down-regulation of oxidative phosphorylation in the liver by expression of the ATPase inhibitory factor 1 induces a tumor-promoter metabolic state. Oncotarget. 2016 Jan 5;7(1):490-508. doi: 10.18632/oncotarget.6357.
- García-Bermúdez J, Sánchez-Aragó M, Soldevilla B, Del Arco A, Nuevo-Tapioles C, Cuezva JM. PKA Phosphorylates the ATPase Inhibitory Factor 1 and Inactivates Its Capacity to Bind and Inhibit the Mitochondrial H(+)-ATP Synthase. Cell Rep. 2015 Sep 29;12(12):2143-55. doi: 10.1016/j.celrep.2015.08.052.
- Formentini L, Pereira MP, Sánchez-Cenizo L, Santacatterina F, Lucas JJ, Navarro C, Martínez-Serrano A, Cuezva JM. In vivo inhibition of the mitochondrial H+-ATP synthase in neurons promotes metabolic preconditioning. EMBO J. 2014 Apr 1;33(7):762-78. doi: 10.1002/embj.201386392.
- Sánchez-Aragó M, García-Bermúdez J, Martínez-Reyes I, Santacatterina F, Cuezva JM. Degradation of IF1 controls energy metabolism during osteogenic differentiation of stem cells. EMBO Rep. 2013 Jul;14(7):638-44. doi:10.1038/embor.2013.72.
- Formentini L, Sánchez-Aragó M, Sánchez-Cenizo L, Cuezva JM. The mitochondrial ATPase inhibitory factor 1 triggers a ROS-mediated retrograde prosurvival and proliferative response. Mol Cell. 2012 Mar 30;45(6):731-42. doi:10.1016/j.molcel.2012.01.008.
- Sánchez-Cenizo L, Formentini L, Aldea M, Ortega AD, García-Huerta P, Sánchez-Aragó M, Cuezva JM. Up-regulation of the ATPase inhibitory factor 1 (IF1) of the mitochondrial H+-ATP synthase in human tumors mediates the metabolic shift of cancer cells to a Warburg phenotype. J Biol Chem. 2010 Aug 13;285(33): 25308-13. doi: 10.1074/jbc.M110.146480.
Tesis doctorales:
- Imke M. Willers. 2011. "Molecular mechanisms controlling the translation of the mRNA encoding the human catalytic β-subunit of mitochondrial H+-ATP synthase in cancer and development” Universidad Autónoma de Madrid. Directores: José M. Cuezva y Álvaro D. Ortega. Sobresaliente “cum laude”.
- Inmaculada Martínez-Reyes. 2012. "Mecanismos y vías de señalización implicados en la reprogramación metabólica en cáncer de colon”. Universidad Autónoma de Madrid. Director: José M. Cuezva. Sobresaliente “cum laude”.
- Laura Sánchez-Cenizo. 2014. "Función oncogénica del inhibidor de la H+-ATP sintasa, IF1: desarrollo y caracterización de modelos transgénicos condicionales y tejido-específicos”. Universidad Autónoma de Madrid. Director: José M. Cuezva. Sobresaliente “cum laude” Premio de la Real Academia de Doctores a la mejor Tesis Doctoral 2014 en el área de Bioquímica (Premio Juan Abelló Pascual I).
- Javier García Bermúdez. 2015. "Regulación de la expresión y actividad de IF1, el inhibidor fisiológico de la H+-ATP sintasa de la mitocondria” Universidad Autónoma de Madrid. Directores: José M. Cuezva and María Sánchez-Aragó. Sobresaliente “cum laude”. Awarded “Premio Extraordinario”.
- Fulvio Santacatterina. 2016. Metabolismo energético en patología y su traslación a la clínica”. Universidad Autónoma de Madrid. Director: José M. Cuezva. Sobresaliente “cum laude”.
- Cristina Nuevo Tapioles. 2019. “Regulación de la OXPHOS mediada por IF1 y su potencial como diana terapéutica en cáncer”. Universidad Autónoma de Madrid.Directores: José M. Cuezva y Laura Formentini. Sobresaliente “cum laude”.
Patentes:
- Method for cancer detection, progression analysis and malign tumor prognosis based on the study of metabolic markers of the cell” European Patent: 03 727 509.6; Canadian Patent 2487176; Japanase Patent: 4235610; United States Patent: 7608403; Date: 2009/08/20.
- IF-1 y mutantes del mismo para su uso como medicamento. ES2 335 373; 24/01/2011.
- Marca PROTEOmAb. 3.055.803. Fecha de publicación: 14/03/2013.
- Procedimiento y kit de diagnóstico diferencial de una enfermedad que cursa con afectación muscular. 10/09.2015.
Otras actividades:
- Somos la Unidad 713 del CIBERER, en el campo de Patología Mitocondrial del CIBER de Enfermedades Raras, Instituto de Salud Carlos III.
- Somos la línea “Translation of Energy Metabolism” en el área de Oncología del Instituto de Investigación Hospital 12 de Octubre (i+12).
- Hemos coordinado el Consorcio MITOLAB de la Comunidad de Madrid.
- Organización del “MITOLAB Closing Meeting” del Programa Madrid I+D, 12-13/11/2015.




















